10 月 25 日,强生制药宣布其 BCMA × CD3 双抗 Teclistamab
(商品名:Tecvayli)
获 FDA 批准在美国上市,用于治疗既往接受过四线及以上治疗(包括蛋白酶体抑制剂、免疫调节剂和抗 CD38 单抗)的复发/难治性多发性骨髓瘤(R/R MM)。
值得注意的是,这是强生获批的第 4 款多发性骨髓瘤疗法
,其皮下注射给药方式在患者依从性方面也具备优势。
Teclistamab 的批准是基于 I/II 期临床试验 MajesTEC-1 研究
(试验登记号:NCT04557098,NCT03145181)
。这是一项单臂、开放标签、多队列、多中心剂量递增研究,以 ORR 为主要终点。
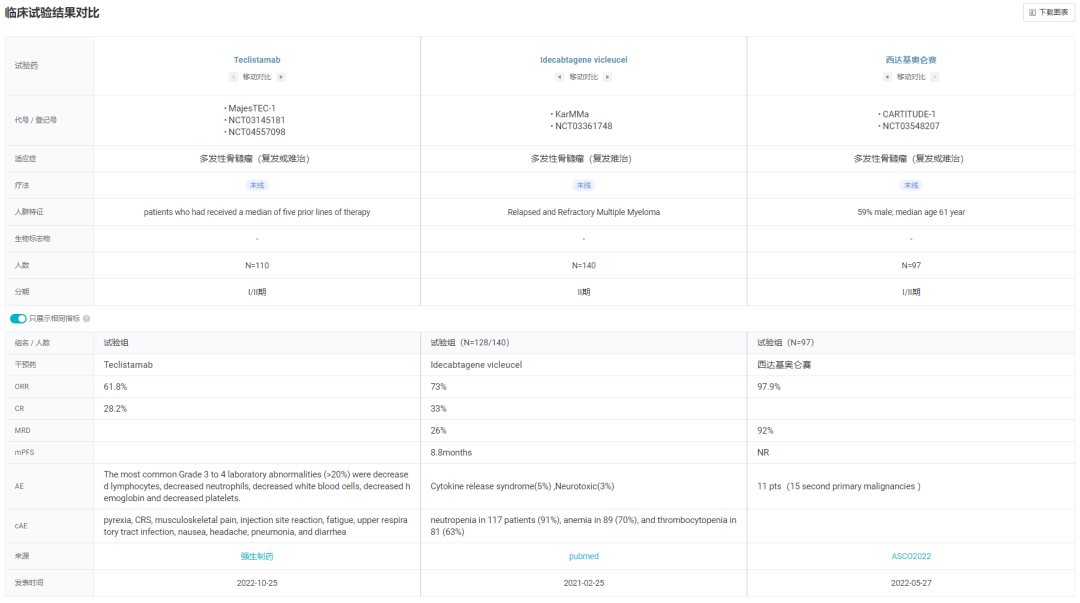
关键 II 期试验纳入既往接受过中位治疗线数五线治疗的患者(n=110),其中 78% 的患者都接受过四线及以上治疗。总缓解率(ORR)达到 61.8%(95% CI:52.1%,70.9%),其中 28.2% 的患者完全缓解(CR)或严格完全缓解(sCR)。
首次响应中位时间为 1.2 个月(范围:0.2 - 5.5 个月)。中位随访 7.4 个月,预估的 6 个月持续缓解(DOR)率为 90.6%(95% CI:80.3%,95.7%),9 个月 DOR 率为 66.5%(95% CI:38.8%,83.9%)。
截图来自:Insight 数据库(http://db.dxyl.cn/v5/home/)
在双抗药物中,T 细胞接合器(T cell engager)与 CAR-T 疗法机制上有相近之处。
这类药物一端与 T 细胞表面表达的 CD3 受体接合,另一方与肿瘤细胞表面表达的肿瘤特异性抗原(如 BCMA)接合,以激活免疫系统,进而杀伤肿瘤。
两类药物一定程度上存在竞争关系,但各有优势。
双抗药物是一种现成疗法(off-the-shelf),不需要当前 CAR-T 细胞疗法漫长的采集细胞、制造回输的过程,且潜在可能有更加亲民的用药成本。而 CAR-T 细胞疗法则通常带来更加亮眼的疗效数据。
以本次获批的 Teclistamab 为例,
同样在末线患者中,其 ORR 达到了 61.85%,CR 率达到了 28.2%,已经接近 BMS/蓝鸟生物的 Abecma,后者 ORR 为 73%,CR 率为 33%。不过,强生和传奇生物开发的西达基奥仑赛
(商品名:Carvykti)
疗效数据仍旧更为亮眼,97.9% 的 ORR 和 82.5% 的 sCR 仍然是难以超越的数字。
(
注:不同临床试验入组患者特征有差异、且非头对头研究,数字上的比较仅供参考,不能直接反映疗效强弱)
三项临床试验数据对比
*点击图片,可放大查看详细
不过据报道,Teclistamab 的月治疗费用为 39500 美元
,折算成年费用,与西达基奥仑赛已经相近,后者定价为 46.5 万美元。
强生已经获批的四款多发性骨髓瘤药物中,CD38 单抗达雷妥尤单抗是 2021 年度全球销售 60.23 亿美元的超级重磅炸弹,且仍在以 43% 的高增速,势如破竹持续增长;CAR-T 疗法西达基奥仑赛尽管今年 2 月刚刚获批,但大有后来居上之势,Q3 单季度销售额就已经达到 5500 万美元,还在高速放量期。
Teclistamab 的批准比起竞争,更多是为强生的多发性骨髓瘤产品组合补充了重要的「弹药」,形成组合优势,相互协同进而更多覆盖到多发性骨髓瘤的各线治疗和各不同条件的人群。
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn
解锁 Insight 数据库网页版更多功能!








 药选址
药选址





