十三届全国人大常委会第二十二次会议2020年10月17日表决通过修改后的专利法,将于2021年6月1日起施行。
对于5月31日前获批新药,有没有专利补偿期,是业界关心的话题,近日国家知识产权局给出了明确的答复:
5月27日,国家知识产权局发布了《关于施行修改后专利法相关问题解答》,对于:新药上市许可申请获得批准的,2021年6月1日起,专利权人可否依照修改后的专利法第四十二条第三款提出专利权期限补偿请求?
国家知识产权局给与了明确答复:对于2021年5月31日(含该日)以前获得上市许可的新药相关发明专利,药品专利权期限补偿制度不溯及既往。
这意味着,在5月31日前获批上市的新药,将失去最高达5年的专利权期限补偿。

答复原文:
修改后专利法将于2021年6月1日起施行

修改内容:
修改内容:
二十七、增加一条,作为第七十六条:“药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。“药品上市许可申请人与有关专利权人或者利害关系人也可以就申请注册的药品相关的专利权纠纷,向国务院专利行政部门请求行政裁决。
“国务院药品监督管理部门会同国务院专利行政部门制定药品上市许可审批与药品上市许可申请阶段专利权纠纷解决的具体衔接办法,报国务院同意后实施。”
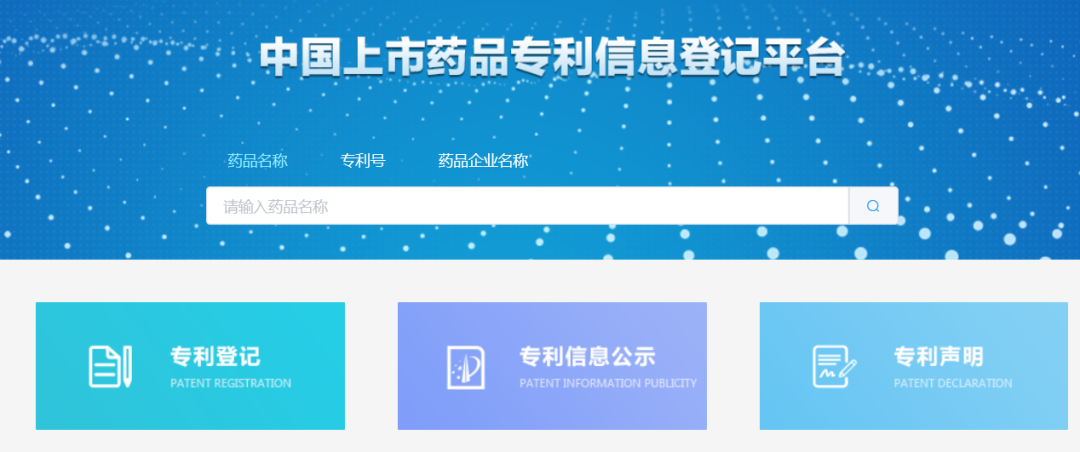
CDE上线药品专利信息登记平台


易企说专访
|
BrainMin 金斯瑞蓬勃生物 |
袁纪军 吉凯医药 |
李庆 Illumina |
周珺 和瑞基因 |
|
汪文 驯鹿医疗 |
李瑞强 诺禾致源 |
付萌 得麦医药 |
操先华 得麦医药 |
|
烨辉医药 华烨 |
BioVillage 楼国强 |
Immune-Onc 廖晓伶 |
康柏睿格 刘刚 |
|
冠科美博 余国良 |
思路迪 熊磊 |
杰毅生物 王珺 |
君实生物 王刚 |
|
新格元生物 方南 |
燃石医学 张之宏 |
赛多利斯 黄献 |
华大智造 蒋慧 |
|
创响生物 王健 |
凯惠睿智 项骏 |
东曹生物 潘明祥 |
Cytiva 俞丽华 |
|
中美冠科 李其翔 |
集萃药康 王韬 |
多宁生物 王猛 |
爱思迈生物 张文军 |
|
康方生物 夏瑜 |
三一创新 尹正 |
安龙基金 赵春林 |
同源康 石斌 |
|
东富龙 程锦生 |
恒瑞医药 张连山 |
复宏汉霖 刘世高 |
博生吉 杨林 |
|
金域医学 赵强 |
高特佳 蔡达建 |
劲方医药 郑彪 |
北极光创投 邓锋 |
|
美雅珂生物 胡朝红 |
高特佳 王曙光 |
平安创投 张江 |
投资人 傅秋实 |
|
元生创投 陈杰 |
Transcenta 赵奕宁 |
启明创投 唐艳旻 |
普华永道 曹菲 |
|
斯道资本 刘为民 |
约印医疗 郑玉芬 |
安永 林江翰 |
辰德资本 胡晓芳 |
近期融资/IPO
|
|
|
|
派真生物 |
|
Immune-Onc |
|
|
|
|
创胜集团 |
思派健康 |
爱博泰克 |
和铂医药 |
|
金普瑞金 |
亚虹医药 |
创响生物 |
冠科美博 |
行业分析
1.提升罕见病用药的可及性,须多方发力
2.CDE公示:武田Mobocertinib胶囊拟纳入优先审评
3.专访舒迪安张勇:加速肿瘤免疫创新疗法开发,推进多样化临床项目管线
4.国产化学发光领军企业亚辉龙生物科创板IPO




 个人中心
个人中心
 我是园区
我是园区




