10月21日,Silverback Therapeutics宣布,FDA已接受2mg肾上腺素鼻喷雾剂neffy的新药申请(NDA)用于紧急治疗I型过敏反应,包括成人和≥30kg儿童患者的过敏反应。如果获批,neffy将成为首个用于I型过敏反应,包括过敏反应患者的非注射治疗产品。PDUFA日期为2023年年中。
Neffy是一种肾上腺素鼻喷剂,采用了鼻吸收增强技术Intravail®。在出现过敏反应的紧急情况下时,相比于现有的肾上腺素自动注射器,Neffy更加容易使用。
I型严重过敏反应是一种严重且可能危及生命的事件,在接触过敏原几分钟内发生,需要立即用肾上腺素治疗,肾上腺素是FDA批准用于这些过敏反应的唯一药物。虽然肾上腺素自动注射器已被证明是非常有效的,但也有一些局限性导致紧急情况下患者治疗受到延迟或得不到治疗,这些原因包括患者对针头的恐惧、缺乏便携性、与针头相关的安全问题、缺乏可靠性以及设备的复杂性等。
在美国,大约有2500万~4000万人经历过I型严重过敏反应,但只有330万人拥有有效的肾上腺素自动注射器处方,其中只有一半坚持携带自动注射器。即使患者或护理人员携带自动注射器,超过一半的人在紧急情况下需要延迟或不使用该设备。
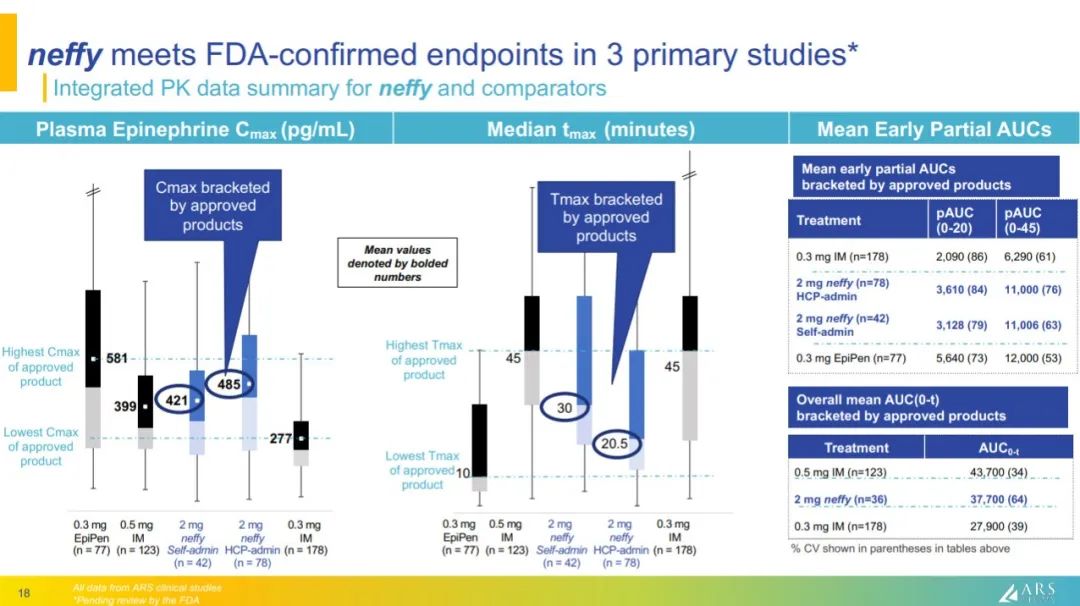
此次上市申请是基于四项关键注册研究的积极数据,达到了所有临床终点。此外,neffy的耐受性良好,超过500例患者接受了至少一剂,大多为重复给药。不良事件大部分是轻微的,没有任何有意义的鼻部刺激或疼痛。
7月21日,
Silverback和ARS Pharmaceuticals宣布达成最终协议,两家公司以全股票交易方式合并,合并后将专注于Neffy的潜在监管批准和商业化。
ARS Pharmaceuticals总裁兼CEO Richard Lowenthal说:“FDA接受neffy的NDA是我们努力为患者提供肾上腺素的一个重要里程碑,鼻喷雾剂药代动力学与肌肉注射相当,但无需针且易于给药。我们赞赏FDA认识到这种新方法治疗严重过敏患者的潜在临床益处,并期待在此过程中与FDA合作,
以
改变
数
百
万患者或
有
严
重
过敏反应
风险
患者的治疗方式
。
”








 个人中心
个人中心
 我是园区
我是园区




