苏黎世大学法学院Kerstin N.Vokinger教授领导的科学家们通过经济评估,研究了2018年和2019年批准的新药的临床益处,并检查了以特殊监管指定批准的药物是否为患者提供有意义的治疗价值后发现:2018-2019年美国和欧洲获批上市新药具有高附加值的不足三分之一。
美国食品药品管理局(FDA)和欧洲药品管理局(EMA)新药批准率在过去十年中不断增加,其中主要的一个因素是FDA和EMA加快监管审查计划的实施,例如,FDA的“加速批准(AA)”和欧盟(EU)类似批准途径“有条件上市许可(CMA)”计划可根据基于所谓的“替代性”指标预测临床益处,以批准新药用于严重或危及生命的疾病。替代措施是可以比临床终点更快地观察到的实验室指标,但可能无法准确预测患者的感觉、疗效或生存情况。美国和欧洲的特殊指定也包括于治疗罕见疾病的药物,并在评估证据时具有很强监管灵活性。
其中一些药物的近期批准和治疗价值存在争议。研究者在这项经济评估研究中,对2018年和2019年批准的新药的临床益处进行了独立评估,并检查了药物是否获批具有特殊监管名称的药物似乎提供了有意义的治疗价值。
在2018年和2019年FDA批准的所有新药(不包括仿制药、生物类似药和诊断药物)中,同时也确定了2021年10月之前也获得EMA批准的药物。从FDA和EMA数据库中,提取了治疗领域(使用世界卫生组织的解剖治疗化学分类系统)、批准日期、适应症、AA、CMA和治疗罕见疾病的特殊指定。
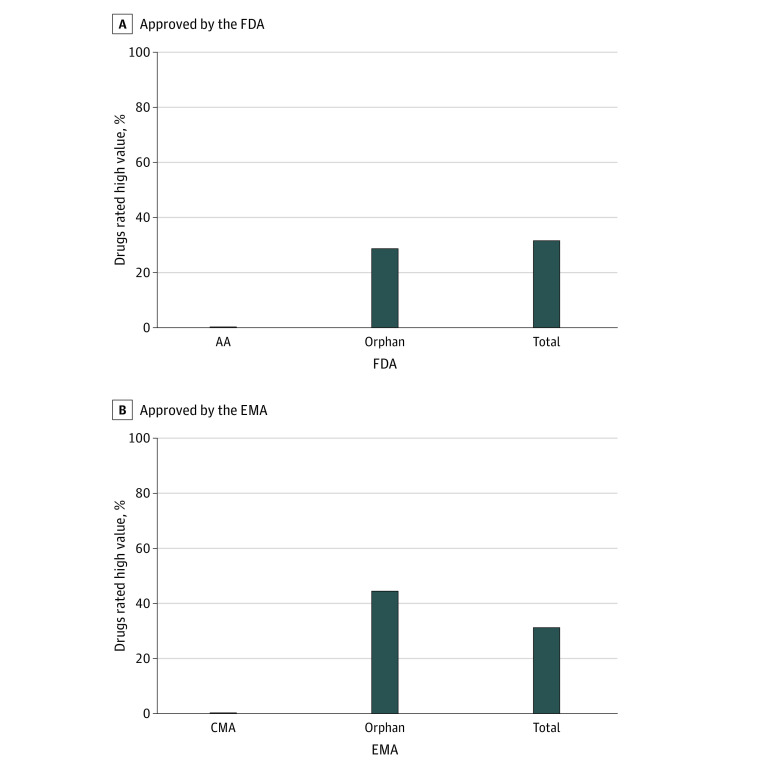
在最终队列的67种药物中,大多数用于肿瘤(26种药物[39%])、神经系统(10种药物[15%])或感染(9种药物[13%])疾病。8种药物(12%)获得AA资格,10种药物(15%)获得CMA资格。超过一半(38种药物[57%])在美国获得罕见病指定资格,超过三分之一(24种药物[36%])在欧盟获得同样资格指定。
有57种药物适合进行治疗价值评级。18种(32%)具有高附加治疗价值,其中没有AA药物和1种CMA药物。分别获得FDA和EMA的特殊罕见病资格指定药物34种的10种(29%)和22种的10种(45%)具有很高的附加治疗价值。
在这项经济评估研究中,研究者发现近年FDA和EMA批准的新药中,只有不到三分之一的新药具有高附加值,这些结果与之前的一项研究一致(侧重于2017年之前批准的药物),没有AA或CMA药物具有很高的附加治疗益处。
参考资料:Therapeutic Value Assessments of Novel Medicines in the US and Europe, 2018-2019
版权声明/免责声明
本文为授权转载文章,版权归作者所有。
本文不具有任何商用、医用、投资用参考意义。
欢迎朋友们批评指正!衷心感谢!
文中图片、视频或为药时代购买的授权正版作品,或来自微信公共图片库,或取自公司官网/网络
根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系(电话:13651980212。微信:27674131。邮箱:contact@drugtimes.cn)。衷心感谢!
 药时代B站号已就绪,速来围观!
药时代B站号已就绪,速来围观!



 药时代B站号已就绪,速来围观!
药时代B站号已就绪,速来围观!



 个人中心
个人中心
 我是园区
我是园区




