
你是否思考过这样一个问题:为何喝茶时手总能准确到达杯子的位置,而且总能把杯子送到嘴边,而非送到眼睛上?
学过初中生物就会知道,这是大脑的功劳。那么,大脑是如何通过精确的调节,来完成这些看似简单的动作?科学研究表明,大脑基底神经节之一的纹状体,尤其是背外侧纹状体,对于运动的产生和调节,发挥着至关重要的作用。
背外侧纹状体主要由两种神经元组成:一种是“直接通路”神经元,可以促进动作的表达;另一种是“间接通路”神经元,可以抑制不想表达的动作。在这两种神经元中,都包含着蛋白激酶 A,这是一种负责催化蛋白质磷酸化过程的酶。
而上述两种神经元的兴奋性,也会受到多巴胺的调控。经典理论认为,多巴胺对于这两种神经元的调控,主要依赖对于两种神经元中蛋白激酶 A 的调节。
通过 1 型多巴胺受体,多巴胺会增加 “直接通路” 神经元中蛋白激酶 A 的活动,进而增强神经元的兴奋性,从而促进运动。
通过 2 型多巴胺受体,多巴胺则能抑制 “间接通路” 神经元中蛋白激酶 A 的活动,进而降低神经元的兴奋性,从而抑制运动。
因此,在这两种神经元中,多巴胺的最终作用都是为了调节运动。如果多巴胺神经元受损,“直接通路”神经元和“间接通路”神经元之间的平衡会被打破,从而引发运动障碍,比如如帕金森病等。
在纹状体中,两种神经元活动的失衡,除了会导致各种运动型障碍疾病之外,也有大量研究表明多种精神类疾病比如精神分裂症、抑郁症的发病机理,也是源于上述平衡被打破。
所以,几乎所有相关疾病的药物研究,都集中于调控多巴胺或多巴胺受体。而多巴胺调节蛋白激酶 A 的经典理论,也在这些药物研发中占据主导地位。
但是,多数支持这一理论的实验证据,均来自于体外实验。体内实验的复杂性往往超出科学家的预测,很多体外实验和体内实验的结果完全不同。
因此,多巴胺是否像经典理论预测的那样,可以调控两种神经元的蛋白激酶 A 的活动?也亟需在体实验的直接验证。
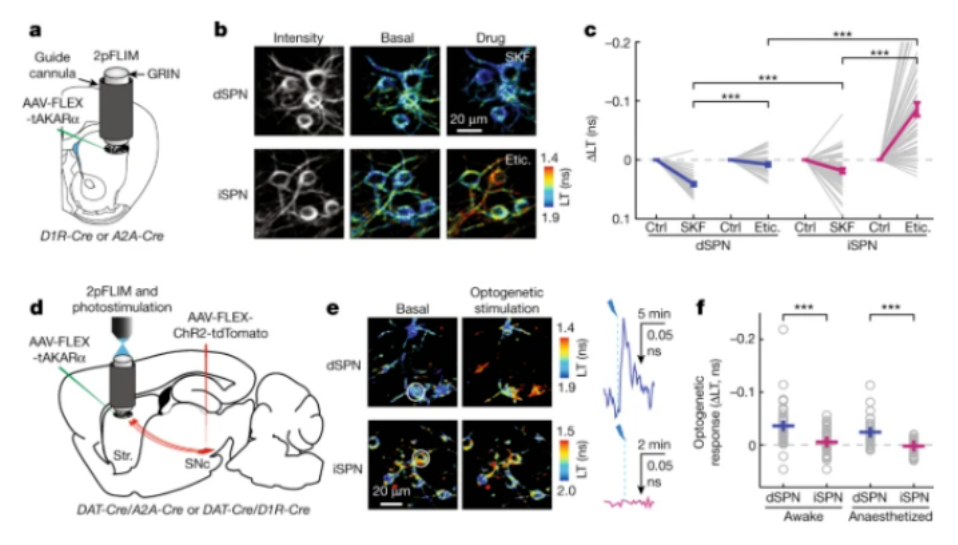
近日,美国俄勒冈健康与科学大学 Vollum 研究所马磊博士和所在团队,通过在体研究发现:和经典理论一致的是,激活多巴胺神经元之后,确实可以增加蛋白激酶 A 在“直接通路”神经元中的活动。
但是,与目前理论不同的是,直接激活多巴胺神经元,并不会降低“间接通路”神经元中蛋白激酶 A 的活动。并且,和目前理论完全相悖的是,小鼠运动会直接增强、而不是降低间接通路神经元中蛋白激酶 A 的活动。

图 | 马磊(来源:马磊)
这项研究还表明,运动不仅会释放多巴胺,也会释放神经递质——腺苷。而在 “间接通路”神经元中,正是腺苷上调了蛋白激酶 A 的活力,从而增强“间接通路”神经元的兴奋性,进而抑制运动。
前面提到,对于两种神经元的调节,多巴胺都起着促进运动的作用。但是,生物系统不能无休止地运动,这就需要一个冷却系统,来防止系统“过热”。
如果多巴胺是“一匹冲刺的野马”,腺苷就是对应的“缰绳”,起着拮抗多巴胺功能的作用。多巴胺和腺苷这对“马与缰绳”的组合,能把“直接通路”神经元和“间接通路”神经元的活动,维持在一个相对平衡的状态,从而对运动系统实施更准确的调节和控制。
就像前面提到的喝茶,在多巴胺的帮助下你才能举起杯子。但是,腺苷这个“缰绳”会让你停下来,不至于将茶“喝到眼睛里”。

拓展药物研发的手段
如前所述,纹状体的功能障碍,会导致帕金森症和众多精神类疾病。当下,治疗这些疾病的药物主要集中在调节多巴胺,比如调节 1 型或者 2 型多巴胺受体。
这类治疗的理论基础,通常基于多巴胺调节“直接通路”神经元和“间接通路”神经元中蛋白激酶 A 的活动。
而这次研究不仅修改了当前的经典理论(即在体激活多巴胺神经元,并不会降低“间接通路”神经元蛋白激酶 A 的活动),并在此基础上引入腺苷这一新型调节机制。
因此,在研发相关药物时,这一成果能让技术手段得到大幅拓展。比如,就目前的多巴胺调节药物来说,病人服用一段时间后,由于多巴胺受体的内调往往会产生抗药性。这时,就可以采用此次马磊提出的调节腺苷或腺苷受体的方法。
当然,也可以研发通过调节腺苷或腺苷受体,来治疗纹状体功能障碍的策略。如果同时调节多巴胺和腺苷,还能实现更精细的调节手段。马磊表示:“我相信,大家看到这篇论文之后,会有更多人把研究方向转移到腺苷。”
(来源:Nature)
近日,相关论文以《运动通过纹状体神经元中的多巴胺和腺苷激活 PKA》(Locomotion activates PKA through dopamine and adenosine in striatal neurons)为题发表在 Nature 上[1],马磊是第一作者,钟海宁教授担任通讯作者。
图 | 相关论文(来源:Nature)
马磊说:“该研究获得三位审稿人的一致认可。他们分别表示:‘这个研究是及时的,未来可以激发大量的相关工作’‘该成果是令人激动的,尤其是腺苷在间接通路中扮演的角色’‘在我看来,作者已经充分解决了此前研究中的空白,是解决其他重要问题所必需的’。”

一条更难的路
马磊身边的几位教授都表示,像这样的审稿意见是极其罕见的。而这一切要从 2018 年说起,当时马磊和所在团队刚研发出新型蛋白激酶 A 活性探针,他和导师正在讨论下一个研究方向。
最简单的就是沿着探针成果,对大脑皮层中蛋白激酶 A 的来源和作用,做进一步的追溯。
因为所有技术都已建立,而且马磊手上还有一些未公布的数据,再做一些药物实验,极有可能在短时间内发表下一篇论文。
另一个思路是做睡眠相关的研究。事实上,在本次 Nature 论文的研究前期,马磊检测了睡眠期间蛋白激酶 A 的活性变化,所得结果非常令人兴奋。如果他继续研究睡眠课题,估计也会收获颇丰。
但是,他和导师走了一条更难的路:研究纹状体蛋白激酶 A 在运动中的活性变化。彼时,从未有人在深层组织监测到蛋白激酶 A 的活性。
马磊等人也没有研究纹状体的经验,而主导该领域多年的理论,几乎也对多巴胺调节蛋白激酶 A 活性的原理做出过定性阐述。
仅用一个新型蛋白激酶 A 探针,对经典理论再做一遍活体验证,似乎是多此一举。那么,马磊为何舍弃两个旁人看来极好的课题,转而追逐更难的?
他表示,既然出国学习就要掌握有挑战的新技术,一直待在舒适区并不是留学的初衷。那时,他刚在 Neuron 上发了一篇论文,组里暂时没有发论文的压力。
而对于纹状体区域蛋白激酶 A 在活体下的活性调节,导师钟海宁教授也很感兴趣。
与此同时,斯坦福大学医学院奥马尔·贾达尔·贝纳维德斯(Omar Jáidar Benavides)来拜访他们,对方也很愿意分享关于纹状体活体成像的技术。
在 Omar 的帮助下,马磊很快掌握了小鼠手术的技巧,还通过自研辅助装备来放置“梯度折射率透镜”,透镜像针一样细小,可以实现对纹状体的成像。他说:“回想第一次看到纹状体神经元的时候,那种欢呼雀跃依旧历历在目。”
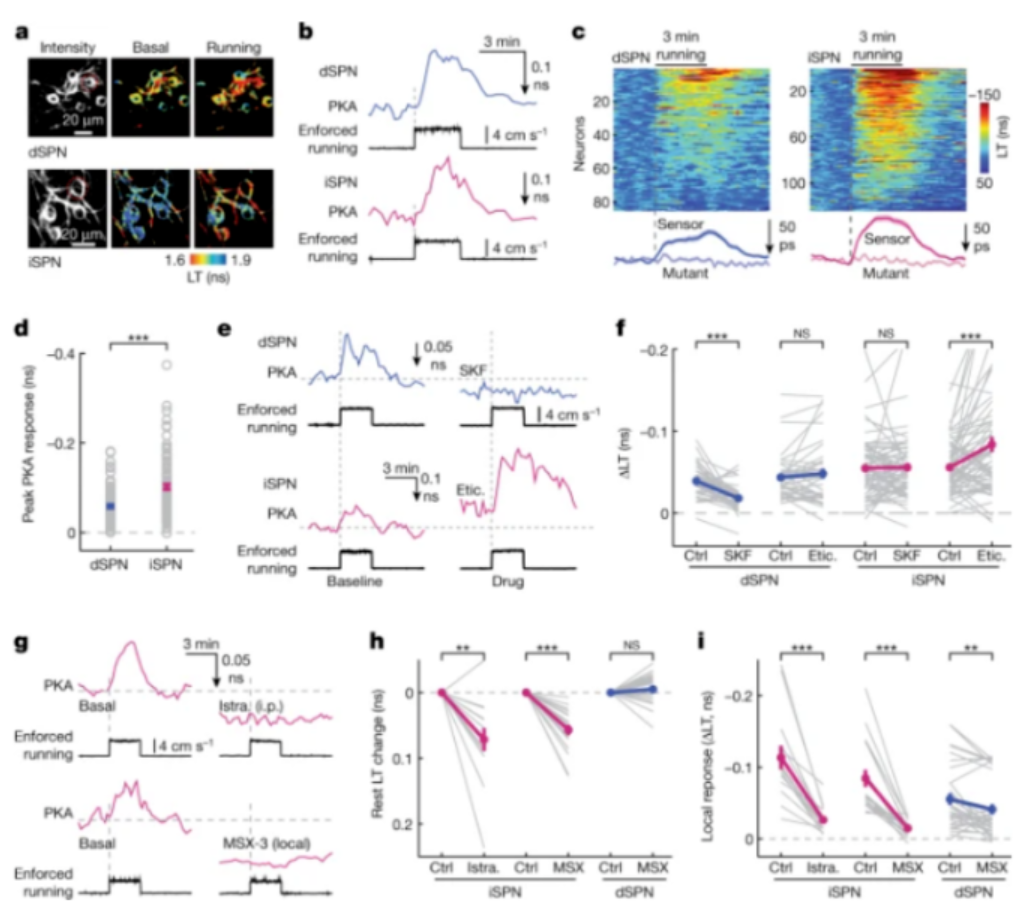
对纹状体进行钙离子活体成像之后,马磊和同事又把蛋白激酶 A 活性探针引入纹状体,让其表达在“直接通路”神经元和“间接通路”神经元中,接着检查其在小鼠运动期间的活性变化。
在运动的作用下,当大家第一次看到“间接通路”神经元中的蛋白激酶 A 活性增强时,所有人都不敢相信。
例行组会上,也有同事发出三连问:是不是搞错了小鼠基因型?这种实验方法也有别人用过吗?是不是手术创伤太大?
总之,对于实验结果大家都是将信将疑。为此,针对不同批次的、相同基因的老鼠,课题组进行多次验证,结果全部一致。这说明,在“间接通路”神经元中,运动会让蛋白激酶 A 活性增强,而不是主流理论中的降低。
那段时间,马磊每天都在测试各种药物,看看到底阻断哪个通路,可以阻断蛋白激酶 A 的活性。
测试四五种药物之后,他开始尝试腺苷 A2A 受体阻断剂。结果显示,通过腹腔注射、或直接在纹状体局部脑区导管给药,都能完全地阻断蛋白激酶 A。
针对运动在“间接通路”神经元中产生的蛋白激酶 A,马磊还得验证是否真的是腺苷 A2A 受体介导的,为此他使用北大团队研发的腺苷探针,对小鼠运动时背外侧纹状体的腺苷水平,进行了实时监测。
结果显示在短时间内,运动确实会让小鼠释放大量的腺苷。这也意味着,阻断腺苷的产生,也会降低蛋白激酶 A 在“间接通路”神经元中的增加速度。最终,所有实验都完美地契合在一起,验证了推论的准确性。
(来源:Nature)
研究中,马磊也感受到了科研前辈对他的关怀。其所在实验室的隔壁是同校教授约翰·威廉姆斯(John Williams)的课题组,后者是纹状体领域的专家,所培养的学生成长为“大咖”的不在少数。
此前,马磊的纹状体研究经验几乎为零,为此约翰教授给出大量建议,几乎是“半个导师”的角色。
“让我印象比较深刻的是,作为领域内的顶尖专家,John 没有一点架子,不会觉得你是个学生就爱答不理的。
我刚来时英语口语还不够好,但是 John 每次都会耐心听我讲述我们的发现。不懂的地方他会立马帮我查,还会专门写邮件给我解释他觉得我可能没听懂的知识。论文发表后,他第一个跑来恭喜我,高兴得像个孩子一样。”马磊说。
(来源:Nature)
而在接下来,马磊希望找到一个精确的腺苷释放来源。目前,大家明确知道多巴胺的释放来源于中脑的多巴胺神经元。这次研究也已明确:运动会直接导致腺苷的释放,但是腺苷的来源并不清楚。
而如果通过调节腺苷,来实现治疗纹状体功能障碍。那么,首要目标就是寻找腺苷的释放来源。
事实上,马磊和同事已经做了不少基础工作,他们发现纹状体区域腺苷的一个非常可能的来源,是星形胶质细胞释放的腺嘌呤核苷三磷酸降解而成。
目前,实验室正在研发能直接对星形胶质细胞进行成像和操作的手段。后续,他们会通过增强或抑制星形胶质细胞,来研究星形胶质细胞对腺苷释放的影响。
再比如,为保持清醒人们会去喝咖啡。如果在网上查一下,你会发现它的作用机制正是抑制腺苷受体的功能。而且,这项作用机制也得到了多项研究的验证。
但是,马磊的初步研究显示,咖啡在直接通路神经元上的作用机制,和现在的理论是完全相反的。
这说明,不仅腺苷是咖啡的作用受体,很有可能还存在另一种受体。最近,他和同事正在寻找潜在的第三种作用受体。

推掉国内 offer,跳出舒适留学国外
据介绍,马磊出生于山东省德州市临邑县老马家村,他说自己“是个地地道道的农村娃。”
其本科毕业于中央民族大学,后保研进入北大,师从甘文标教授,主要研究睡眠类课题。
他说:“我是甘文标教授在国内的第一个学生,导师绝大多数时间在美国,所以在一开始,很多东西都要一边自学一边摸索。”
比如,在判断小鼠进入睡眠状态的脑电波记录时,需要使用一种电极。制备电极时需要什么样的材料?怎么做焊接?把它插在小鼠的哪个位置?这些都得马磊自行解决。
而且,电极还不能干扰小鼠的活体成像,也不能被活体成像的信号所干扰。为满足所有条件,他足足耗时几个月,期间尝试了多种方案。
最后,他终于实现了脑电波信号的稳定记录,同时不会被活体成像的信号打扰。截止目前,这一方案已被多家实验室采用。
正是利用这一方法,马磊以共同一作的身份,发表了课题组第一篇睡眠相关的论文,揭示了快速动眼睡眠通过处理一部分不重要的新突触,从而让大脑腾出空间学习其他东西的机制。
那篇论文于 2017 年发表在《自然·神经生物学》。“目前论文引用已有 366 次,远超同类论文的引用数。论文发表后,我也有在国内找工作的打算,也收到了深圳大学、青岛大学医学院的 offer。然而我很清楚,急匆匆地成立实验室并不是很好的选择,我得换个环境来锤炼自己。”马磊说。
导师甘文标也告诉他,在一个地方的成功,并不能完全证明你的能力;如果换一个地方,仍能做出让人信服的成绩,那才说明这份成功并不完全依赖所在实验室。于是,在导师的推荐下,马磊来到了现在的实验室。
刚来美国时,课题组正在研究一种新型蛋白激酶 A 活性探针。但是,当时还没有办法监测其在活体状况下、或在某种行为学下的活性变化。
为此,马磊专门给小鼠造出一款电机控制型跑步机。利用跑步机,可以精确控制小鼠的跑步速度和跑步时间。当小鼠在运动时,他们成功监测了蛋白激酶 A 活性的变化,相关论文已发表于 Cell 子刊。
目前,已有多家实验室向马磊和导师,表达了对于这款探针的兴趣。也有几家实验室使用这款探针做出了突破性研究。
马磊表示:“利用蛋白激酶 A 活性探针,我们最近还发现了和多巴胺通路所拮抗的腺苷通路,修改并补充了主导该领域多年的多巴胺理论。我在 2022 年也正式从博士后转成了助理科学家。”
“据我所知,目前利用双光子荧光寿命成像,来对蛋白激酶 A 进行活体成像的技术,在国内还没有实验室可以做到。如果有机会,我想回去把这项技术建立起来,促进国内科研圈在这方面的进步。”他在最后表示。





 个人中心
个人中心
 我是园区
我是园区





