

未通过一致性评价的仿制药逐步退市不可避免。4月17日,江苏省公共资源交易中心发布《关于公示暂停采购部分未通过仿制药质量和疗效一致性评价药品的通知》,暂停采购未通过仿制药一致性评价品种152个。此前,北京市医药集采服务中心也发布类似通知,并公示暂停采购843个未过评的仿制药产品。
此前,包括上海、深圳、广东、江西等多个省市,均开始执行了“同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种”的政策[1]。
同时,依据国家药品监督管理局发布的《关于仿制药质量和疗效一致性评价有关事项的公告(2018年第102号)》(以下简称“102号文”),仿制药在规定期限内不能完成一致性评价,将不予再注册,失去药品批准文号。
本文旨在对仿制药一致性评价的开展必要性、评价方法、评价内容、以及一致性评价的鼓励政策进行梳理和探讨。
仿制药一致性评价是仿制药质量和疗效一致性评价的简称,是指对已经批准上市的仿制药,按与原研药质量和疗效一致的原则,分期分批进行质量一致性评价[2]。
其中,对于仿制药的口服固体制剂的一致性评价研究通常包括两个部分,一是以体外药学研究为主的质量一致性研究,二是以生物等效性研究或其他临床研究为基础的疗效一致性研究。
2012年1月,国务院《国家药品安全“十二五”规划(国发[2012]5号)》(以下简称“5号文”)。
提出全面提高仿制药质量,对2007年修订的《药品注册管理办法》施行前批准的仿制药,分期分批与被仿制药进行质量一致性评价。
为我国首次在正式的法规中提出进行仿制药的一致性评价。
仿制药一致性评价的目的在于全面提高仿制药质量。实际上,我国作为仿制药大国,虽然本土企业生产的药品中,约有95%为仿制药,且临床使用的药品中,仿制药也占据了多数比例。但是,我国的仿制药一直以来存在质量参差不齐,甚至部分仿制药与原研药在治疗和疗效上均有明显差距的问题。
因此,为了提高仿制药质量和疗效,实现仿制药与原研药能够真正的相互替代,保障公众用药安全,有必要全面开展仿制药质量与疗效一致性评价。
原研药与仿制药的定义和开发流程的不同,导致二者在药品本身方面即存在差异
在我国,原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品[3]。依据美国FDA网站对原研药的定义,原研药是指以专有的商标保护名称销售的药物
(A brand-name drug is a drug marketed under a proprietary, trademark-protected name)
。
仿制药,指具有与原研药品相同的活性成份、剂型、规格、适应症、给药途径和用法用量的原料药及其制剂[3]。
依据FDA网站定义,仿制药指在剂量,安全性,强度,服用方式,质量,性能和预期用途方面与品牌药物相同
(A generic drug is the same as a brand-name drug in dosage, safety, strength, how it is taken, quality, performance, and intended use
)。通常仿制药的主要目的是对原研药的活性成分进行复制。
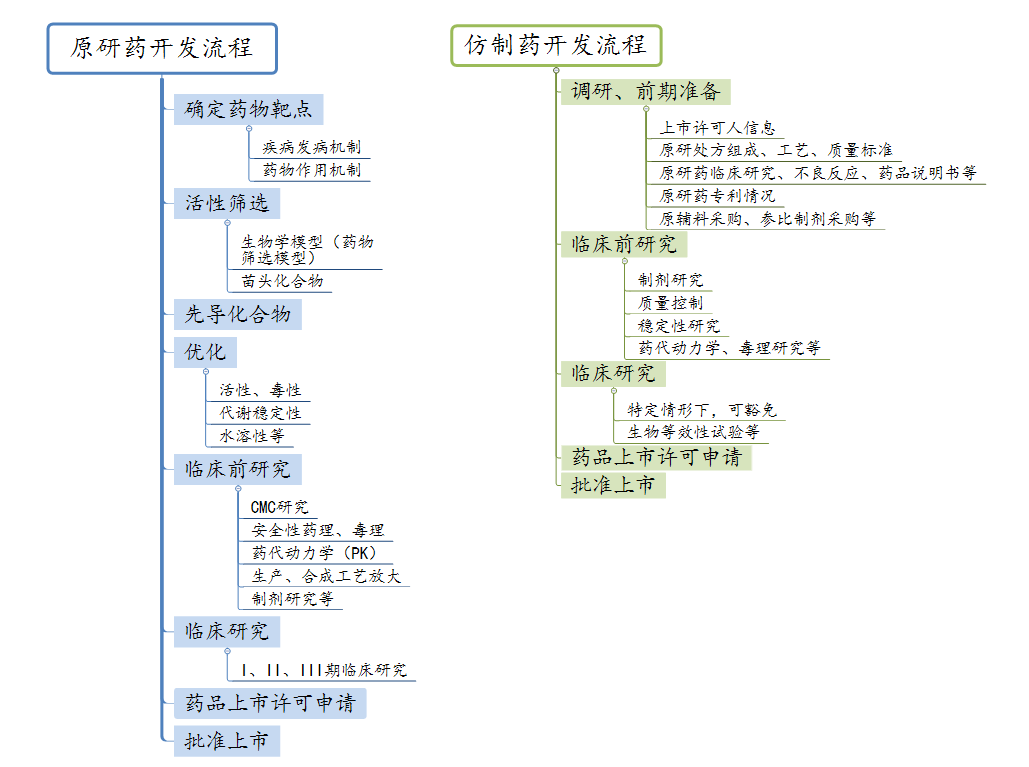
如图所示,原研药的开发经历了确定药物靶点、候选化合物活性筛选、先导化合物优化、临床前研究以及漫长的临床研究,一般原研药从研发到最后注册上市的时间大约长达十多年之久,耗资更是以数亿美元计,是一个周期长投资资金大的复杂工程。
但是,也正因如此,原研药有其长期、大量的试验检验和临床检验作为保障,其疗效和安全性能够被充分信赖。同时,为了保持原研药企的创新动力,原研药通常都具有专利权,在专利过期之前不可被仿制,并且享受单独定价等政策的保护,因此原研药通常价格高。
仿制药由于其省略了药物开发过程中前期的多个阶段,通常主要工作从制剂研究开始,其临床试验部分的要求也相对简单,因此投资周期短、成本低、见效快、价格低是其最突出的特点。
如前所述,仿制药是对原研药的活性成分进行复制,由于存在规避专利、降低成本的需求,以及原研药处方工艺和生产工艺往往难以准确获得,同时主辅料获取渠道也通常不同,因而仿制药的原料药晶型、制剂处方和生产工艺、辅料种类等均有可能与原研药不同,而这些不同成为了仿制药和原研药治疗和疗效可能存在差异的内在原因。
我国早期相对宽松的政策也导致了仿制药与原研药在质量和疗效上的差距
我国早期对于仿制药的定义,是指生产国家食品药品监督管理局已批准上市的已有国家标准的药品的注册申请
(2007版《药品注册管理办法》第十二条)
。实际上,我国对于一致性评价的比较对象的要求,也存在变化,如下图所示:
比较对象的选择显然决定着仿制药质量和疗效的评价效果,而我国早期的仿制药评价是与“被仿制药”比较。严格来讲,“被仿制药”不同于“原研药”或“参比制剂”,其本身的质量和疗效即可能与原研药存在差异,因而有可能造成“越仿越差”的局面。
由上述比较可以看出,我国法规和相关政策对于仿制药质量和疗效的比较对象愈趋严格,只有以原研药或等同质量的参比制剂作为“标杆”,才能真正全面提高仿制药质量和疗效,实现仿制药与原研药在临床上的相互替代,保障公众用药安全。
顾名思义,一致性评价的对象肯定是仿制药。依据2016年3月,原国家食品药品监督管理总局发布的《化学药品注册分类改革工作方案》,仿制药划分到第3类和第4类,《化学药品注册分类改革工作方案》要求其应与原研药品的质量和疗效一致,即目前想要使新的仿制药品种获批上市,应当评价其是否“与原研药品的质量和疗效一致”。
而在化学药品新注册分类实施前已经获批上市的仿制药,国务院办公厅8号文明确,“化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价”。
同期,原国家食品药品监管总局发布的《关于落实国务院办公厅关于开展仿制药质量和疗效一致性评价的意见有关事项的公告
(2016年第106号)
》中也明确,化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。
依据前述国家药品监督管理局102号文,对于国家基本药物目录中的仿制药品种的一致性评价,取消了统一设置的评价时限,但是保留了“关门”政策,原则上的“关门”时间点为首家品种通过一致性评价后的三年。
综合上述政策,仿制药一致性评价的对象和时限可整理如下图所示:
以口服固体制剂为例,仿制药一致性评价研究通常包括以体外药学研究为主的质量一致性研究,以及以生物等效性研究或其他临床研究为基础的疗效一致性研究。
仿制药一致性评价的申报资料的原则上包括:概要、药学研究资料、体外评价和体内评价四部分内容,研究内容主要包括如下方面[4]:
如前所述,仿制药一致性评价的目的在于使仿制药在临床上能够与原研药相互替代,即治疗等效。
上述研究内容中,药学指标研究、体外评价目的在于证实仿制药与原研药的药学等效,而生物等效性试验
(BE试验)
或其他临床试验的目的,在于证实仿制药与原研药的生物等效,只有在药学等效和生物等效同时被认可的情况下,才能充分证明其安全性和有效性,实现真正意义上的治疗等效。
从上述对于研究内容的具体项目不难发现,仿制药一致性评价主要内容在于质量是否可控、疗效/安全性是否可靠,因此申报资料的披露是否完整、准确、合理、严谨至关重要。由于篇幅有限,以下部分仅对BE试验和临床有效性试验展开探讨。
依据现行指导原则,仿制药体内评价原则上应采用BE试验,对符合《人体生物等效性试验豁免指导原则》
(食品药品监管总局通告2016年第87号)
的品种,经企业申报,一致性评价办公室组织审核后公布,允许该药品生产企业采取体外溶出试验的方法进行一致性评价。在找不到或无法确定参比制剂的情况下,则需开展临床有效性试验[5], [6]。
依据原国家食品药品监督管理总局《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》
(2016年第61号)
,BE试验指在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内。
同时,BE试验按照研究方法评价效力,其优先顺序为药代动力学研究、药效动力学研究、临床研究和体外研究。
以药动学参数为终点评价指标的生物等效性
(PK-BE)
研究即:通过测定可获得的生物基质
(如血液、血浆、血清)
中的药物浓度,取得药代动力学参数作为终点指标,藉此反映药物释放并被吸收进入循环系统的速度和程度。通常采用药代动力学终点指标Cmax和AUC进行评价。
如前文所讨论,原研药经过临床前研究后,通常还需要进行I-IV期临床试验,以充分验证试验药品的安全性和有效性,而为何仿制药一致性评价使用BE试验来进行体内评价呢?
如前所述,原研药是境内外首个获准上市的药物,因此在其获批前,也必须进行相应的临床试验来证明其安全性和有效性。
而对于仿制药中的口服固体制剂,PK-BE研究实际考察的是原研药与仿制药的API自各自的制剂中释放出后,经肠道吸收入血进入人体循环而被人体吸收这一过程中,吸收速度
(以参数Cmax表示)
和吸收程度
(以参数AUC0-t、AUC0-∞表示)
的比较,通过比较参数Cmax、AUC0-t和AUC0-∞来判断仿制药与原药在吸收速度和吸收程度上的差异是否在可接受范围内,通常情况下,这些参数的几何均值比值的90%置信区间
(CI)
数值在80.00%~125.00%范围内,即可判定生物等效。
图片来源:国家药品监督管理局药品审评中心推进仿制药一致性评价工作沟通交流讨论会会议PPT资料
如上图所示, API经制剂崩解、药物溶出溶解在介质中,被肠壁吸收入血,再经体循环达到作用部位而发挥疗效。
为了证明仿制药与原研药的疗效一致性,认为如果需要仿制药与原研药在作用部位发挥的作用一致,则需要API在血液的浓度和暴露量也应该一致,因此对于仿制药疗效和安全性的确证,可采取BE试验。同时,也由于PK试验参数Cmax、AUC的客观性和可靠性,因而以药动学参数为终点评价指标的评价效力是最高的。
由此可见,BE试验是仿制药的一致性评价的重点,也是一致性评价的审评重点,依据国家药品监督管理局药品审评中心
(CDE)
的公开数据,对于BE试验的审评,方法学验证及样品检测的发补问题占到70%以上,其它占比较高的问题为统计分析、试验涉及、参比制剂等。
因此,在进行BE试验时,首先要科学、合理地设计试验方案、统计分析计划和标准操作指南
(SOP)
等规范性文件,注意规范性文件中应事先明确定义出样本量、随机化方法、药代动力学参数集
(PKPS)
、生物等效性集
(BES)
、数据剔除标准、复测条件、采血点超窗处理、脱落数据的处理、离群值处理、异常值处理、方案偏离处理等,并在试验报告中严格按照事先规定的标准进行处理和操作。
同时,BE试验报告应当完整、规范、准确、清晰地进行记录,例如参比制剂的证明材料、试验药的检验报告、方法学验证报告、生物样品检测报告等。
临床有效性试验适用于找不到或无法确定参比制剂的仿制药[7],大多数情况下,找不到或无法确定参比制剂的品种,主要是我国的一些国内特有品种,可能存在以下几种情形:
▨ (i)改剂型、改规格、改盐基的品种;
▨ (ii)国内缺乏临床数据的特有品种;
▨ (iii)市场淘汰品种等。
仿制药一致性评价临床有效性试验的比较类型主要包括优效性试验和非劣效性试验。由于没有参比制剂,临床有效性试验的对照药一般可分为安慰剂对照和阳性对照药。为明确疗效,鼓励选择安慰剂对照进行优效性临床试验。但如为细胞毒类药品等特殊情况不适合应用安慰剂对照,也可选择阳性对照药进行非劣效性临床试验。
临床有效性试验的终点指标可使用普遍接受的临床终点指标;也可使用有价值的替代终点或生物标记物,遵循科学、准确、灵敏、有效率的原则,以实现评价仿制药有效性的目的。
据相关法规和规章的规定[6],通过一致性评价的品种和企业将主要受惠于:
▨ 药品生产企业可在药品说明书、标签中予以标注;
▨ 纳入《新批准上市以及通过仿制药质量和疗效一致性评价的化学药品目录集》;
▨ 医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用;
▨ 同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种;
▨ 通过一致性评价的药品生产企业的技术改造,在符合有关条件的情况下,可以申请中央基建投资、产业基金等资金支持等。
仿制药通过一致性评价只是一个开始,其质量和疗效还需要在过评后不断进行验证与再验证,持续进行改进和提升,以保障仿制药在整个生命周期中与原研药品治疗和疗效的一致。国家药品监督管理局正在采取积极措施以避免一致性评价变为“一次性评价”。
前述国家药品监督管理局102号文提出,要严格评价标准,强化上市后监管,通过一致性评价的药品,纳入下一年度国家药品抽验计划,加大对相关企业的监督检查力度。据悉,国家药监局也正在组织制定有关规定,以规范通过审评的药品制剂在原料药、辅料、药品包装材料和容器方面的变更管理。
另一方面,在固体口服制剂的仿制药一致性评价工作积累了一定经验的基础上,注射剂的一致性评价也或将正式拉开帷幕。2019年3月,国家药监局药品评审中心发布的《化学仿制药参比制剂目录
(第二十一批)
》中,出现了首个注射剂参比制剂。
2019年09月30日,国家药监局综合司公开征求《化学药品注射剂仿制药质量和疗效一致性评价技术要求
(征求意见稿)
》、《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求
(征求意见稿)
》意见。
我国仿制药一致性评价的逐步全面开展,一方面,可以调整我国国内制药行业产业结构,国家出台多项政策,鼓励药品生产企业持续对其仿制药产品进行一致性评价,而未过评的品种将不得不面临暂停国家集采、药品批文被注销,最终退市的后果。
另一方面,一致性评价能够通过大幅提高仿制药质量和疗效,以促进国产仿制药品出口。同时,通过将完成一致性评价的仿制药品与国家基本药物、医保药品以及药品集中采购相关联,实现药品质量和价格联动,这对于药品持证商、药品生产药企以及临床、公众用药均具有重大意义。
[1] 国务院办公厅《关于进一步改革完善药品生产流通使用政策的若干意见》(国办发 [2017]13号)
[2] 国务院《关于改革药品医疗器械审评审批制度的意见》(国发[2015]44号)
[3] 原国家食品药品监督管理总局《化学药品注册分类改革工作方案》(2016年第51号)
[4] 原国家食品药品监督管理总局《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》(2016年第120号)
[5] 国务院办公厅《关于开展仿制药质量和疗效一致性评价的意见》(国办发[2016]8号)
[6] 原国家食品药品监督管理总局关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号)
[7] 原国家食品药品监督管理总局《仿制药质量和疗效一致性评价临床有效性试验一般考虑》(2017年第18号)
植德生命科学组专注于生命科学及医疗健康全产业链条的法律服务及其前沿研究,包括药品研发、临床实验研究、药品生产、生物技术、医疗器械与医疗服务等,为该等领域的研究机构、生产企业、销售企业、医疗机构、投资机构提供包括知识产权、投融资、并购、跨境药品研发与交易、员工激励与人力资源整合、合规、反不正当竞争与商业秘密保护、上市、反垄断等在内的法律服务。
植德生命科学组包含多名具有生物化学及法学复合背景的合伙人、律师、专利代理师,其成员曾服务于国内外顶级律所、政府部门、法院、企业、科研单位等不同机构,植德生命科学组致力于为生命科学领域的客户一站式提供立体化、全周期的法律服务。
合伙人 钟月萍
010-56500930
yueping.zhong@meritsandtree.com
合伙人 唐华东
010-59210933
huadong.tang@meritsandtree.com
声明:以上所刊登的文章仅代表作者本人观点,不得视为植德律师事务所或其律师出具的正式法律意见或建议。如需转载或引用该等文章的任何内容,请注明出处。未经本所书面同意,不得转载或使用该等文章中包含的任何图片或影像。如您有意就相关议题进一步交流或探讨,欢迎与本所联系。
联系方式:lifescience@meritsandtree.com















 个人中心
个人中心
 我是园区
我是园区






