游方和尚专栏 | 胆汁酸,奥贝胆酸,FXR与NASH/NAFLD: 奥贝胆酸最终能否获批上市?
收藏
关键词:
上市获批
资讯来源:生物制药小编 + 订阅账号
所属行业:化学药制剂 + 订阅行业
发布时间:
2020-09-13

Intercept Pharmaceuticals, Inc. (ICPT) 于2019年2月19日宣布了治疗 NASH导致肝纤维化的奥贝胆酸 (Obeticholic acid,OCA), 一个法尼醇X受体(FXR)受体激动剂,在关键的临床3期研究(NCT02548351,REGENERATE)中表现出积极的结果。在主要疗效分析中, 每日一次25毫克剂量的OCA,在计划的18个月中期分析中,达到了≥1级的纤维化改善并且NASH没有恶化 (p = 0.0002 vs. 安慰剂) 的主要终点(表2A)。在另一个主要终点上,与安慰剂相比, 两个OCA治疗臂中的更多的患者达到了NASH消退并且肝纤维化没有恶化的终点,但此项指标的没有取得统计意义。据ICPT与美国食品药品监督管理局 (FDA) 达成的协议, 只需要结果满足上述两个主要终点之一,就算达到这项研究的首要终点。
但是在2020年6月29日,ICPT在一份声明中说:FDA在回复ICPT的CRL信中说,迄今审查了的数据表明,奥贝胆酸,或OCA的预期治疗收益是不确定的,并不足以超过潜在的风险,以支持加速批准。FDA建议ICPT,从正在进行的REGENERATE研究,提交额外的,中期(interim)的有效性和安全数据分析之后的数据,以支持潜在的加速批准;并且建议该研究的长期研究阶段应该继续。该公司的CEO,Mark Pruzanski,说:“他对FDA的决定感到失望,该决定是基于显然不完整的审查,没有为医学专家和患者提供机会,在预期的Adcom会议听取他们表达的意见和OCA的优点,而OCA是一个指定的突破性疗法”。而且,FDA已经逐渐地增加了病理组织学终点的复杂性,创立了一个非常高的标杆;目前仍然只有OCA在关键的临床III期研究达到了此标准”。
那么,OCA究竟是否会得到FDA的上市批准呢?至少,OCA至今为止在临床III期上的成功,即便是勉强的成功,和之后FDA拒绝加速批准其上市的挫折,对NASH药物的继续研发,特别是FXR激动剂这一类的药物,究竟意味着什么呢?本文将基于胆汁酸作为一个信号分子,及其相关受体,转运蛋白,等,在NASH/NAFLD中的作用, 以及目前在研的相关药物的状况作一个初步介绍。重点是基于FXR激动剂或其下游产物在治疗NASH/NAFLD上的主要药理机制,试图回答“OCA究竟是否会得到FDA的上市批准”的问题,并希望起到抛砖引玉的目的,促进这方面的思考和创新药的研发。
法尼醇X受体(FXR)属于核激素受体的受体家族。作为对某些代谢产物的响应,这些受体蛋白与目标基因的启动子(promoters)中的cis-作用元素结合而调节相关的基因表达。1995年, Forman等人首次描述了FXR。FXR最初因其结合法尼醇而被激活而得名, 在1999年,确定胆汁酸 (BA, Bile Acids)为FXR的生理配体之前, 它一直是一个"孤儿"受体。
FXR在参与BA代谢的组织中高度表达, 如肝脏、肠道和肾脏。处于生理浓度的偶联和未偶联胆汁酸盐能够激活FXRs。FXRs通过调节参与BA合成、分泌、偶联、转运、吸收和解毒的基因来调节BA平衡。当FXR结合BA后, 会抑制胆固醇7α-羟基酶(CYP7A1)的基因表达, 这是BA合成中的速率限制酶。此外, BA激活 FXR,也会增加一个重要的转运蛋白,即the cytosolic intestinal bile acid-binding protein(I-BABP),的表达。该蛋白质在BA代谢中起着重要的作用:它促进BA从肠道穿过肠细胞和经肝脏门脉循环进入到肝脏。BA影响肝损伤和肝切除后的肝脏再生。
胆汁酸(BA,Bile Acids)是肝脏从胆固醇合成的两极类固醇分子, 并成为胆汁的主要组成部分之一。BA主要指amino-acyl-conjugates of the primary BAs, cholic acid [CA],chenodeoxycholic acid [CDCA], 与其二级代谢产物。肝细胞将其主动分泌到胆汁的是其合成的主要驱动力。BA与其他胆汁成分一起, 排入小肠, 在乳化和吸收膳食脂肪、胆固醇和脂溶性维生素中发挥作用。在到达回肠终端后, BA几乎完全 (95%) 被主动吸收。这限制了其在粪便中的损失为0.2-0.6克/天, 这些损失与每日的BA合成达成平衡。在远端小肠和结肠中, 初始BA、CA和CDCA通过常驻细菌进行脱硫和脱水, 导致次生性BAs,即脱氧胆酸[DCA]和石质胆酸[LCA]的形成。这些次生性BA可以被动地重新吸收, 并构成在肠道循环中的总BA池的一部分。BA在系统循环和周围组织中浓度极低(由于有效地被肝脏提取),仅在餐后有少量增加。
多年来人们认为, BA的功能主要限于刺激肝胆汁流动和胆汁排泄, 以及帮助消化和从肠道吸收脂肪。然而,过去二十多年的研究表明, BA可能通过各种受体作为信号传输分子, 以调控自身的合成以及其它代谢过程,如葡萄糖, 脂肪, 和能量的代谢平衡。BA通过激活的各种特定的受体进行调控, 这些受体包括核受体超大家族的成员 (法尼醇X受体[FXR; NR1H4] , 维生素D受体[NR1I1], 和pregnane X受体[NR1I2]), 以及G蛋白耦合受体超家族(TGR5和sphingosine-1-phosphate receptor 2)的成员。
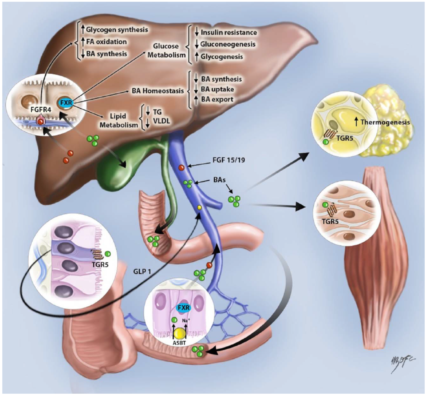
这些受体不仅在参与BA肠道循环的组织中表达, 也在肝脏和胃肠道系统之外表达, 在那里它们介导BA的全身作用。目前对BA调控作用的理解大部分来自涉及FXR和TGR5受体的研究, 尽管BA的代谢作用可能也涉及其他途径(图1)。这些BA调控受体可能影响非酒精性脂肪肝炎/肝病(NASH/NFLD)的在多个层次上的发(进)展和恶化。
关于FXR对糖代谢的影响,使用全身FXR受体敲除小鼠(FXR-KO)的研究表明, 这些小鼠表现出胰岛素敏感性下降。相反,在肥胖ob/ob和糖尿病db/db小鼠中使用选择性、非类固醇FXR激动剂GW4064, 可以改善胰岛素抵抗和葡萄糖平衡。在FXR-KO小鼠中接受能表达具有活性的FXR受体的腺病毒之后,血浆葡萄糖水平会降低;但使用GW4064治疗时,则不会降低血浆葡萄糖,这表明胰岛素需要FRX受体的存在才能起作用。血液中CA、CDCA、和DCA的浓度与人体胰岛素敏感性负相关,这与BA在胰岛素抵抗中的作用一致。
此外, 使用FXR激动剂GW4064后糖尿病db/db小鼠的肝糖原合成会增加。这种效应可能,至少部分地,是通过诱导FGF15(人类为FGF19)的表达来调节的。这是一种非典型FGF, 是能在肝脏和更遥远的器官中直接调节代谢作用的类似激素的生长因子。FGF15已被证明能刺激糖原合成。最后, 还应注意, 在一些小鼠模型肥胖中,缺乏FXR受体可能改善, 而不是恶化葡萄糖平衡。因此, BA介导的肝葡萄糖代谢调节是复杂的。虽然大多数研究支持FXR激活时胰岛素敏感性可得到恢复的概念,但有必要做更多研究,特别是在人体上。
近年来, FXR在调节脂质代谢方面的作用也得到了阐明。FXR-KO小鼠表现出促血管粥样硬化的脂蛋白特征, 血清和肝胆固醇及甘油三酯明显升高。此外, 在db/db和野生型小鼠中(不包括FXR-KO小鼠), FXR激动剂可降低血浆胆固醇、甘油三酯和游离脂肪酸 (FA) 水平。FXR激动剂降低甘油三酯作用的几个可能机制包括:1. 抑制固醇-调节元素结合蛋白1c(SREBP-1c)的表达;2. 通过涉及非典型核受体小异体伴侣(SHP)的通路;3. 依赖于FXR的PPAR 诱导表达。因此, FXR的激活能够抑制肝脏脂质的内部合成, 刺激FA的氧化, 限制肝脂累积。
此外, FXR还调节与甘油三酯代谢相关的其他几个关键基因, 如微体甘油三酯转移蛋白、极低密度脂蛋白(VLDL)受体、syndecan-1(一种与在残留颗粒转移到受体之前结合的蛋白质), FA转运蛋白, CD36和脂蛋白 (Apo), CII和CIII。因此, FXR可以通过诱导脂蛋白脂酶(LPL)的活化剂Apo CII的表达和抑制LPL活性抑制剂ApoCIII的表达来促进血浆VLDL中的甘油三酯清除。
图1. 在若干种组织中, BA作为信号分子的作用原理的演示: 核受体FXR被肝脏产生的BA激活, 具有多种下游效应, 包括抑制脂质生成,减少BA合成,减少葡萄糖生成, 增加胰岛素敏感性,等。BA还激活肌肉和脂肪组织中的Takeda G-蛋白耦合受体5(TGR5), 增加发热和能量消耗。此外, 在肠道中激活 TGR5可促进GLP-1从L细胞中的释放, 这反过来促进胰岛素从胰腺-细胞释放。在回肠末端中, 在ASBT(ileal apical sodium-dependent bile acid transporter, 或ileal bile acid transporter (IBAT))摄入BA后, BA激活FXR, 其刺激FGF15/19 (小鼠/人)的产生,分泌,并通过血液循环达到肝脏。当FGF19与肝细胞中的FGFR4/-Klotho结合后, 则会抑制BA合成, 促进肝糖原储存和脂肪酸(FA)氧化。预期FXR激动剂也具有上述药理作用。缩写:TG, 甘油三酯。
肠道中的一个关键FXR的靶基因是成纤维细胞生长因子-15/19(FGF-15/19,小鼠/人)。在肠道主动吸收BA及之后,回肠细胞中FXR受体激活,其直接上调FGF-19的表达。在肝细胞中, FGF15/19(小鼠/人)结合FGF受体4(FGFR4)和-Klotho共同受体, 通过直接抑制胆固醇7羟基酶(CYP7A1)表达, 从而减少BA的合成。抑制胆固醇7α-羟基酶和减少BA合成已知有利于肝脏再生。这些结果突出了FXR激活对肝脏生长和再生的影响及其在临床实践中的潜在重要影响。此外, FGF15/19还能减少肝脂生成, 并间接刺激线粒体FA氧化。因此,FXR通过若干互相联系和制衡的机制调节胆固醇的体内平衡。
肝纤维化是慢性肝损伤的常见特征,是由肝细胞死亡引起的。肝细胞死亡导致凋亡体和其他细胞碎片, 这些碎片由肝硬质细胞(HSCs)吞噬, 导致其活化、增殖、分化和分泌和沉积细胞基质。肝细胞死亡的这种促纤维化效应可以通过HSC凋亡所获得的抗纤维化效应取得平衡状态。
FXR已被证明与肝硬化有关。肝硬质细胞(HSCs)的活化导致细胞外基质蛋白的分泌,促进了肝纤维化的进程, 最终导致肝组织疤痕。最近的研究表明, FXR在大鼠和人类硬脂细胞中表达, FXR的激活减少了这些细胞外基质蛋白的表达。此外, 激活FXR能预防和逆转啮齿动物的肝纤维化。
FXR激动剂作为肝胆病的潜在治疗药物,因其在几种人类肝病的实验模型中的安全状况和经证实的疗效而备受关注。FXR激动剂是慢性肝病患者的一类有吸引力的药物。除了他们的在调节BA,碳水化合物和脂质代谢方面起着关键作用, 它们也具有强大的抗炎症和抗纤维化特性。如前所述,慢性肝病患者OCA的临床经验表明,FXR激动剂是安全,有效的并在所有NASH 3期临床药物研究中率先达到FDA设定的临床终点。
在2002年发现的G-蛋白耦合胆汁酸受体1(GPBAR1,也称为Takeda G-蛋白耦合受体5[TGR5])和随后的研究所阐明的TGR5在哺乳动物生理中的潜在作用极大地支持了下述概念:作为信号传导分子的BA,其作用组织,超越了肝-肠循环。TGR5分布广泛, 表达在脂肪细胞, 肌细胞、免疫细胞、窦道内皮细胞、胆管上皮细胞和Kupffer细胞、肠内分泌细胞、神经元和肠道神经系统,对生理和病理发挥着广泛的影响。与 NAFLD/NASH 相关的是TGR5在调节能量消耗、葡萄糖代谢和免疫方面所发挥的作用, 下文将对此进行简短的讨论。
对小鼠的研究表明, 激活棕色脂肪组织(BAT,brown adipose tissue)和肌肉组织中的TGR5会上调能量消耗。这是通过上调II型碘甲状腺素去碘酶(D2) [Type 2 iodothyroninedeiodinase(D2)] 的基因而激活BAT和肌肉的热发生(thermogenesis)。II型碘甲状腺素去碘酶(D2)将无生物活性的甲状腺素(T4)转化为活性3,5,3'-三碘甲状腺素(T3), 致使氧气和能量的消耗增加。人体研究发现, 血清BA水平与能量消耗相关, 健康女性受试者接受CDCA的短期治疗增加了BAT活动性和全身能量消耗。
甲状腺释放控制人体基础新陈代谢的激素, 即甲状腺激素,因而控制我们身体使用能量的方式和程度。甲状腺激素调节重要的身体功能,包括:呼吸,心率,中枢和周围神经系统,体重,肌肉力量,月经周期,体温,胆固醇水平,等等。甲状腺激素,通过激活其受体β亚型(THR-β),在控制脂质代谢中起着核心作用。临床上已证明,甲状腺激素受体亚型激动剂, 如Resmetirom(MGL-3196,处于临床III期研究,见扩展阅读#4, 5)和VK2809(处于临床II期研究,见扩展阅读#1,4,5),在NASH患者中降低脂肪沉积/变性的效果显著,因而在治疗NAFLD/NASH及代谢综合症上极具潜力。因此,TGR5激动剂也可以间接地起到甲状腺激素受体亚型激动剂的药理作用,但其效果可能不如直接使用甲状腺激素受体亚型激动剂。ICPT 正在开发INT-767: 一款口服的,具有抗纤维化和抗炎作用的FXR受体和TGR5受体的双重激动剂,并已完成临床I期研究。
TGR5受体也通过其在肠道enteroendocrine L 细胞上的作用,参与调节葡萄糖平衡。激活这些细胞上TGR5会诱导胰高血糖素样肽-1 (GLP-1)的释放。GLP-1是一种肠激素,是由在回肠和结肠中的L细胞响应肠道内的营养成份,如碳水化合物和脂肪,而分泌的激素。在胰腺中, GLP-1增加胰岛素合成和释放, 并通过抑制细胞凋亡和刺激细胞增殖来维护胰腺-细胞的功能。此外, GLP-1通过尚未不明确的机制减少食欲和食物摄入量。虽然碳水化合物被认为是在肠道中GLP-1释放的主要刺激物, 但Thomas等人在体内使用药理学和遗传学方法(genetic gain- and loss-of-function)方法的组合, 表明肠道内的BA也刺激TGR5, 导致肠道GLP-1释放, 和GLP-1相关的改善了肥胖小鼠的葡萄糖耐受性以及肝脏和胰腺功能。有趣的是, 最近的证据表明TGR5也由胰腺-细胞表达, 因此TGR5也可能调节胰岛素分泌。
作为上述研究的一个注脚:不久前,Gilead Sciences 和Novo Nordisk宣布在NASH方面开展合作。Gilead 将贡献两个临床II期项目, 与 Novo的Semaglutide 组合使用。Semaglutide已经以注射剂上市(Ozempic), 其口服制剂目前正在FDA的上市审核中。Semaglutide 是一个适合口服使用的长效 GLP-1 激动剂。至于作为降血糖的Semaglutide能否在NASH临床研究的时间段内,能够改善NASH的组织病理或停止/逆转纤维化尚未可知,笔者拭目以待相关临床数据的发表。
鉴于TGR5也在单核细胞中表达,包括Kupffer细胞, 即驻留肝脏的巨嗜细胞, 其调控会影响炎症反应。这些细胞中TGR5的激活,通似乎过抑制抗炎作用因子nuclear factor kappa B进入细胞核和抑制细胞因子的产生,引起强烈的抗炎症效应。此外, 小鼠研究表明, TGR5调节脂肪组织和肝脏的巨噬菌体极化和组织渗透, 从而减少代谢炎症。
6. 针对与BA相关代谢通路的药物治疗NAFLD/NASH的前景
鉴于通过FXR和TGR5的信号传输对脂质和葡萄糖代谢的影响, 调控这些受体的药物会影响内源的BA水平(即BA转运蛋白调控剂或BA固存剂)并在NASH/NAFLD中可能提供有益的治疗效果 (图1)。事实上, 小鼠和人类研究的新证据表明, FXR(肝脏或肠道)和/或TGR5的调控可能通过增强胰岛素分泌和敏感性,抑制脂肪合成和刺激脂肪氧化,因而有益于NASH/NAFLD患者。
FXR激动剂,OCA,虽然已在临床III期研究中达到FDA设定的临床终点。但其是否能够被批准上市,尚有很大的不确定性。下一个问题是:是否值得继续开发更好的FXR小分子激动剂?答案似乎是肯定的,但摆脱骚痒这样的副作用也可能只是研究者的一厢情愿。加上其它可能的肝毒性,这就限制了OCA能使用的剂量,其总体疗效就很有限。一个办法当然是找到引起骚痒的分子机制,从而开发出避免骚痒的FXR小分子激动剂。另一种办法,也是笔者推荐的,即开发FGF19类似生物药,彻底绕过骚痒这个障碍。后者无疑是成功几率较大的选择。最近发布了两个FXR激动剂, EDP-305和MET409,的临床II期数据,但瘙痒仍然是个很大的问题。
2019年9月25日,Enanta Pharmaceuticals发布了另一个FXR激动剂,EDP-305,的临床2a研究(ARGON-1)数据。该研究测试了两个剂量(1mg 和2.5mg)的EDP-305,高剂量组的肝酶水平下降了28单位/升,而安慰剂组下降了15单位/升。结果刚刚超过有统计学意义的阈值,与OCA临床测试中减少28单位/升的指标一致。接受高剂量EDP-305的患者肝脂肪(MRI-PDFF)在统计学上显著减少。45%受试者是MRI-PDF应答者,即取得 ≥30%的脂肪减少。EDP-305 也表现出强大的靶标参与度,如C4的减少以及 FGF-19和ALP的增加;也观察到了GGT的强力降低。
总体而言,EDP-305总体上是安全的,大多数与治疗相关的不良事件(TEAEs)是轻度至中度。最常见的 (≥5%)包括瘙痒(pruritus),胃肠道(GI)相关症状(恶心,呕吐,腹泻),头痛和头晕。迄今为止,在所有研究中,在400多个接受EDP-305的受试者中,都观察到了一致的安全性特征。至于EDP-305在这个为期12周的临床2a研究中的耐受性,则不令人乐观:在2.5mg剂量组中,大约51%的受试者存在瘙痒,而在1mg手臂中,低于10%的受试者出现瘙痒;大多数瘙痒是轻度或中度。因瘙痒导致的停药率分别为1.8%(1 mg剂量组)和20.8%(2.5 mg剂量组)。在2.5mg剂量组中,所有停药都是由于中度瘙痒。
EDP-305 是一种强效的,非胆汁酸 FXR 激动剂,其含有类固醇和非类固醇元素,但不包含通常存在于其它类别的FXR激动剂和天然胆汁酸中的羧酸,这个羧酸可与taurine和glycine形成耦合物。虽然曾经有希望非胆汁酸 FXR 激动剂不会引起瘙痒的预期,但事实看来并非如此。因此对于EDP-305,更令人担忧的是接受EDP-305治疗而出现瘙痒的患者人数。超过一半的高剂量组受试者出现瘙痒,超过20%的人因此退出了研究;这劣于OCA:使用OCA72周后,的安慰剂调整后的瘙痒发生率为32%,停药率为9%。EDP-305能够与OCA竞争的可能性是有争议的,如果未来没有更好的数据发布。EDP-305看起来与OCA完全一样,除了低10倍的剂量;但剂量差异是无关紧要的,因为药理学(安全性和药效)在各自的剂量看起来几乎完全相同。
2020年8月27日位于美国加州圣地亚哥的Metacrine,Inc.,一家专注于发现和开发治疗肝脏和胃肠道疾病的差异化疗法的临床阶段生物技术公司,发布了为期12周的随机,安慰剂控制的MET409 临床1b 研究最终的积极结果,MET409 是该公司的非胆汁酸FXR激动剂,用于治疗NASH。
在临床1b概念验证研究中,58名NASH患者随机入组,以1:1:1的比例接受,每天一次口服80毫克,或50毫克的MET409,或安慰剂。研究结果显示,MET409降低了肝脏脂肪含量,80毫克组平均相对减少55%;50毫克组,减少38%;而安慰剂组,减少了6%(P < 0.001)。值得注意的是,在80毫克组中,93%(13/14)的患者,和50毫克组中的75%(12/16),以及安慰剂组中的11%(2/18)的患者的相对肝脂肪减少了30%或更多(P<0.001)。MET409还使80毫克组中29%的患者(4/14)和50毫克组中31%的患者(5/16)的肝脂肪含量正常化至5%或更低,而安慰剂组(P=0.05)中没有患者肝脂肪含量降低5%或更低。除了肝脂肪减少,MET409治疗产生了指向有30%或更大的相对ALT减少的趋势:80毫克组中的50%(7/14)患者,50毫克中的31%(5/15),而安慰剂中只有17%(3/18)(P > 0.05)。结果还显示,80毫克组患者中的64%(9/14)的患者,和50毫克组的81%(13/16),以及0%安慰剂组, 相对-GGT减少了30%或更多(P <0.0001)。在第8周的一部分患者中观察到瞬态,无症状ALT和AST升高,但-GGT 或总胆红素没有增加。MET409在接受治疗的患者中一般耐受性良好,没有报告与药物相关的严重不良事件。80毫克组中40% (8/20)的患者,和50毫克组别中16%(3/19)的患者报告generalized pruritus(普通瘙痒)(轻度-中度),被确定为与MET409有关。只有两个 受试者(10%)因瘙痒而早期停药。从基线到研究的第84天,在80毫克剂量下,与药理机制相关的LDL-C的上升达到23.7%;50 mg剂量时,上升了6.8%;而安慰剂则为1.5%的降低(与80毫克组相比较:P<0.05)。
总之,MET409在降肝脂方面效果很好,似优于EDP-305(Enanta)和Cilofexor(Gilead),瘙痒副作用方面与OCA差别不大,可能略优;对于组织病理学方面的改善,还需要等待临床II数据(如果使用肝活检来评估对纤维化的疗效的话)。由于此研究的规模很小(总共58人);因此,对于这个小样本量的临床1b研究结果,应当保持谨慎乐观。
靶向选择性地激活TGR5的是治疗NAFLD的一个有吸引力的方法, 因为TGR5受体激活可以改善葡萄糖平衡, 限制体重增加, 以及改善NAFLD/NASH造成的肝损伤。虽然此类药物的研发展最初面临BA结合TGR5的结合亲和力相对较低的问题, 之后,使用药用化学方法, 以及从植物提取物的天然化合物库中筛选, 已发现了十几种具有强效TGR5活性的化合物。ICPT公司的CA衍生物, 6a-ethyl-23(S)-methylcholic acid (INT-777), 是一个在研选择性TGR5激动剂;接受INT-777的HFD喂养的小鼠增加了能量消耗和较少的体重增加。此外, INT-777治疗改善了小鼠的肝酶水平, 并减轻了肝脂肪性脂肪。尽管上述结果看来很有希望,但唯一一项对糖尿病患者使用TGR5激动剂的人体研究只得到了令人失望的结果,因为葡萄糖水平显著地增加了,而并没有像预期的那样降低。总而言之,基于TGR5的疗法是否在代谢疾病和NASH/NAFLD上有效仍需要更多研究。
在另一方面, 获得特定的TGR5/FXR特异性调控是有挑战性的, 因为BA或类固醇相关的化合物对一个受体的选择性可能只保有对另一个受体的弱亲和力或者体内代谢可能将TGR5或FXR"特异性"激动剂转换为对这两个受体都有活性的激动剂。开发对FXR和TGR5都具有明显活性的激动剂药物应该是具有优越性的。使用FXR/TGR5双激动剂INT-767治疗db/db肥胖小鼠,McMahan等人发现,INT-767能够减少肝脂肪变性, 减少促炎细胞因子的表达, 并将单核细胞和巨噬细胞转向抗炎的M2表型。
此外, 鉴于TGR5信号通路在调节肠道GLP-1分泌方面至关重要, 其靶向调节可能有益于器官特异性的胰岛素敏感性,肝脂处理和脂肪组织功能障碍。值得注意的是, 有研究表明, 在相当比例的接受liraglutide(GLP-1类似物)的受试者中取得NASH组织学上的消退。此外,INT-767还降低了胰岛素抵抗, 降低了关键代谢器官中的新肝脂质生成和脂毒性。因此, 增强GLP信号的转导值得进一步研究, 以确定其在干预NASH疾病进程上的潜在功能。不久前,Gilead Sciences 和Novo Nordisk宣布在NASH方面开展合作。Gilead 将贡献两个临床II期药物, 与 Novo的Semaglutide 组合使用。Semaglutide已经以注射剂上市(Ozempic), 其口服制剂目前正在FDA的上市审核中。Semaglutide 是一个适合口服使用的长效 GLP-1 激动剂。
肠道,特别是回肠,中的BA进入肠细胞后刺激FXR而导致FGF19的产生和分泌,并作为一个代谢类激素,经血液循环到达肝脏和其它靶标组织。在肝细胞中, FGF19结合FGFR4/-Klotho受体复合体, 直接抑制,作为BA合成的主要调节酶的胆固醇7羟基酶(CYP7A1),的表达。此外, FGF19还减少肝脂生成, 并间接刺激线粒体FA氧化。
目前唯一的临床研究阶段的,基于FGF19的生物药是来自NGM Biopharmaceuticals的Aldafermin(NGM282);目前已完成一个临床II期研究,数据喜人。比较详细的介绍请参阅扩展阅读#4。鉴于篇幅,此处暂不作进一步论述,可参阅图1和下一节。
1. FXR激动剂
: 尽管OCA是否将成为FDA批准的首个用于NASH纤维化患者的用药,也是首个FXR激动剂,仍然是一个悬念,其副作用(OCA 25毫克剂量组),高达51%的患者经历多数是轻度至中度瘙痒事件,5%的患者经历重度瘙痒事件和3%的患者经历胆结石或胆囊炎,意味着市场需要新的和更好的,即副作用更小的,FXR 激动剂。同时,OCA的最终药效仍有提高的空间,因为大多数患者仍是无响应者,例如OCA 25 mg 组的响应率仅为23.10%; 在取得NASH消退并无纤维化恶化的终点上只有11.70%的响应率,并且未取得统计学意义上的显著效益。此外,EDP-305的临床II期结果,似乎摆脱不了的瘙痒副作用更是给所有小分子FXR激动剂的前途蒙上一层阴影。MET409在降肝脂方面效果很好,但仍然有与OCA几乎相当的瘙痒副作用。
一个策略是为了优化响应率而寻求临床效益更佳的,副作用更小的FXR激动剂或联合使用2-3个药理机制不同的药物。一个显然的组合是OCA与甲状腺激素受体β亚型激动剂,如Resmetirom 或VK2809。这个组合将弥补OCA在降低脂肪沉积/变性和NASH消退方面疗效不足的遗憾,有望同时达到FDA设定的两个有效终点(见扩展阅读#5)。一个TGR5/FXR双受体激动剂,由于其在甲状腺激素信号传输通路上的药理作用,似也有一定的潜力。OCA与Aramchol的组合也可能是一个不错的选择。
FXR激动剂的抗纤维化作用似乎有可能是独立于其调节葡萄糖和脂肪代谢的功效。一个纤维化发生的实用假设是肝硬质细胞(hepatic stellate cells, HSCs)的活化,通过细胞外基质蛋白的分泌而导致肝纤维化, 最终导致肝组织疤痕。最近的研究表明, FXR在大鼠和人类HSCs中有表达, 而FXR的激活减少了这些细胞外基质蛋白的表达。此外, FXR激活已被证明可预防和解决啮齿动物的肝纤维化。因此, 可以推测FXR激动剂可能直接作用于导致肝纤维化的细胞和信号转导通路, 促进纤维化的消退和逆转;另一方面, 也可能通过减少肝脏脂质化并防止肝细胞凋亡,间接地促进纤维化的消退和逆转。FXR激动剂的抗纤维化作用也有可能是通过FGF19介导的(见扩展阅读#4)。因此,FXR,及相关其下游靶标,代表了调控肝脏脂质代谢和纤维化的一个可信度较高的靶点。
2. 非促癌的FGF19类似物
:一般而言,对开发FGF19类似生物药的担心在于其在小鼠上表现出的促癌性(tumorigenicity)。
NGM Biopharmaceuticals 通过蛋白工程改造开发了一个基于FGF19 的非促癌性的生物药:NGM282 (现称为Aldafermin)可有效抑制新胆汁酸合成。FGF19是一种调节胆汁酸合成和葡萄糖稳态的激素。临床前研究表明, NGM282调节多个与NASH致病机制相关的通路, 如抑制新脂质生成、提高胰岛素敏感性、纠正线粒体功能障碍、减少肝炎症和纤维化。在一个临床II期研究中,总体而言, 50%和63%接受1毫克或3毫克的NGM282的患者, NAS评分分别改善2点或更多, 无纤维化恶化;同时,分别有25%和42%的患者, 其肝纤维化改善一个级别或以上, 脂肪性肝炎无恶化。这已达到FDA设定的可以批准上市的III期临床终点。这些临床药效较OCA更加优异,同时,也没有引起骚痒这样可恶的副作用(见扩展阅读#4)。因此,从药理机制和临床的安全性,有效性和患者的依从性(涉及副作用)考虑,笔者相信,在动物模型上非致癌性的类似NGM282(Aldafermin)的FGF19蛋白药物,相信能做到每周,或每月,甚至每季度,皮下注射一次,其患者接受的程度会远优于OCA这类小分子FXR激动剂,有可能成为巨大的NASH市场的宠儿。
3. TGR5激动剂和TGR5/FXR 双重激动剂
: 小鼠研究表明, 激活棕色脂肪组织(BAT,brown adipose tissue)和肌肉组织中的TGR5会上调能量消耗。这是通过上调II型碘甲状腺素去碘酶(D2)的基因而激活BAT和肌肉的热发生(thermogenesis)。II型碘甲状腺素去碘酶(D2)将无生物活性的甲状腺素(T4)转化为活性3,5,3'-三碘甲状腺素(T3), 致使氧气和能量的消耗增加。甲状腺激素信号传导是人体调节代谢平衡的最重要的机制之一,我们从自然存在的甲状腺过多或缺乏的病患情况可以清楚地认识到这一点。甲状腺功能减退的症状包括体重增加,升高的胆固醇和血清脂质,体温过低和抑郁,如果发生在怀孕期间,可能包括认知缺陷。甲状腺功能亢进症状包括降低胆固醇,心动过速,心律失常,高热,体重减轻,肌肉分解代谢,骨矿化减少,中枢神经系统发育和情绪障碍的破坏。甲状腺素的功能是由甲状腺激素受体的和亚型所介导的。其中,甲状腺激素,通过激活其受体β亚型(THR-β)在控制脂质代谢中起着核心作用。甲状腺激素具有降低胆固醇,改善血脂特征和治疗肥胖等有益作用。在最近一项基于人群的甲状腺功能受试者研究中,游离T4的水平与甘油三酯和胆固醇,血压,腹部肥胖和胰岛素抵抗的血液水平表显出负相关性。甲状腺受体β亚型激动剂能够,通过降低低密度脂蛋白胆固醇 (LDL-C),增加高密度脂蛋胆固醇(HDL-C)再摄取,刺激反向胆固醇转运和降低血浆甘油三酯,等,改善脂质谱。目前,似乎还没有TGR5激动剂和TGR5/FXR 双重激动剂进入临床II期研究;感觉需要优良的临床II期的efficacy数据,才能判断这类药物在NASH上的潜力。
4. IBAT抑制剂
:笔者尚未对IBAT抑制剂作系统性的介绍。下面仅就最新的,与NASH相关的临床研究结果作简短评述。
2020年8月18日,Albireo发布了Elobixibat 在一个NASH临床II期研究(47个肝活检证实或代谢症状诊断的NASH/NAFLD受试者,每日口服一次5 mg Elobixibat, 共16周)的结果,并决定不再对Elobixibat在NASH适应症上进行下一步开发,虽然elobixibat在临床中实际上到达了其主要临床终点。Elobixibat降低LDL的效果几乎是安慰剂的两倍:Elobixibat的降低幅度为20.5 mg/dL,而安慰剂的降低幅度为11.1 mg / dL。但在对NASH的疗效上,Elobixibat作用可算是隔靴搔痒:服用elobixibat的受试者的ALT水平没有显著变化,肝脏脂肪含量也仅减少了2.6%(MRI-PDFF)。
Elobixibat 是一个first-in-class,每天口服一次的回肠胆汁酸转运蛋白(IBAT)抑制剂。其已在日本上市,用于治疗慢性便秘患者(不包括由有机疾病引起的便秘)。之前,预期Elobixibat及同类药物可以减少胆汁酸在肠道的再吸收,进而减少脂肪在肝脏中的堆积。这些指标的改善对于缓解肝脏疤痕和炎症以及抑制脂肪和血糖升高,预期有临床疗效。现在看来,这些预期的药理作用机制(MOA)并未显现出来。根据图1的演示,IBAT抑制剂虽然抑制BA的重吸收,这也同时意味着BA没有机会激活FXR和随后的FGF19的产生,及其后续调控多个代谢过程的机会。而且,理论上,BA再吸收的减少会导致BA合成的增加,也许至少可以说,正面与负面作用二者相抵消了。因此,笔者感觉此处的一个教训是需要避免传统药理学中的线性思维,而采纳定量与系统药理学中的网络思维(见扩展阅读#9)。一个生物体,特别是一个或几个器官/相关的代谢调控通路,等,都是相互紧密联系的,可以说是牵一发而动全身;而药物对生物系统的扰动(perturbation),引起的绝大多数药理响应都有counter regulatory mechanisms 产生负反馈,以抵消药物的作用。因此,药物靶点的选择至关重要。
2020年8月27日,在 “2020年国际肝脏委员会线上会议暨第55届欧洲肝病研究委员会(EASL)年度会议”上,Intercept Pharma公司发布了对临床研究REGENERATE的中期数据进行事后归因分析(a post hoc review of the interim analysis data)的报告。这些数据和分析结果表明:奥贝胆酸(OCA)在长达两年的治疗中能够持续改善NASH患者的肝脏生化指标和肝纤维化非侵入性标志物。
加州大学圣地亚哥NAFLD研究中心主任,加州大学圣地亚哥医学院肝病学主任,医学博士Rohit Loomba表示:“使用药物治疗NASH导致的高度纤维化(advanced fibrosis)的首要目标是可以停止其进展到,乃至逆转,肝硬化(cirrhosis),及其破坏性极大的并发症的发生。来自REGENERATE的新的非侵入性检测数据进一步证实了OCA可以帮助NASH患者达到这一目标。令人欣喜的是,多种非侵入性检测数据表现出持续且稳定的改善;这些非侵入性检测是医生们日常用于监测和管理患者的手段。接受OCA治疗后,肝硬度的显著改善特别值得注意。这些新的数据让我们对OCA更有信心,因为它持续地提供了有意义且持久的收益;这已经超过了,在治疗18个月后,已经取得的肝脏病理组织学上的改善和收益。”
在之前报道的REGENERATE的18个月中期分析中,每天一次服用25mg的OCA达到了改善纤维化的主要临床终点(≥1 stage),并且NASH病情没有恶化;与安慰剂相比具有高度统计学意义(p = 0.0002 vs.安慰剂)。此次,新数据来自中期分析有治疗意向(intent-to-treat ,ITT)人群的患者;这些患者在足够早的时候就进行了随机分组,以保证在中期分析时同时拥有可评估的第18个月肝活检数据(N=251-263/治疗组)和第24个月肝活检数据(N = 120–125/治疗组)。同时,还分析了下列参数,从研究开始时的基线数值到治疗后第24个月,的变化:ALT,AST,γ-GGT,纤维化的血清标志物(FIB-4,AST与血小板比率指数[APRI])和肝硬度(Liver stiffness, FibroScan® vibration-controlled transient elastography [VCTE]; subset, N = 64‒70 per arm)。
与安慰剂相比,接受OCA治疗的患者的转氨酶和其它生化指标的平均值迅速改善,并持续超过了18个月以上。根据FibroScan VCTE的检测结果,经过24个月的治疗,与安慰剂相比,接受OCA的患者的肝脏硬化程度得到改善;服用25mg OCA的治疗组与安慰剂组之间的平均差异为2.7 kPa。在基线时,病人的肝硬度中位值处于高度纤维化(advanced fibrosis)的范围内;在第24个月时,接受25 mg 日剂量OCA治疗的患者肝硬度中位值低于阈值7.9 kPa,并且多数接受25 mg OCA治疗的患者已从高度变为中度纤维化(moderate fibrosis)。此外,转氨酶和纤维化非侵入性标志物的变化与组织学纤维化的变化,密切相关;其最大的改善是在第18个月表现出≥1 stage纤维化改善的患者中。同时,这些生化指标的早期变化,在第18个月表现出≥1 stage纤维化改善的患者中,也更为显著。总体而言,这些非侵入性检测数据表明,长期服用OCA对肝硬化有明显的fibrosis reduction的作用,且持续超过18个月。
在进行此次中期分析时(interim analysis,24个月的随访),ITT人群亚组中OCA 25 mg治疗组的总体不良事件概况,总体上与整个ITT人群中观察到的一致。最常见的不良事件是瘙痒。严重不良事件的发生率在OCA 25 mg治疗组与安慰剂组之间平衡分布。几乎没有严重不良事件发生在多位患者中,并且未观察到一致的严重不良事件的发生模式。
总而言之,这些数据和分析,进一步展示的长期使用OCA治疗,可以持续地改善有高度肝纤维化的患者的肝脏生化指标和肝纤维化非侵入性标志物;鉴于这些非侵入性检测结果与肝纤维化组织病理学的密切关联,可以推论患者的肝纤维化组织病理学也得到了改善。这是有关非常有意义的推论,这也在某种程度上证实BA在肝纤维化,乃至肝硬化和肝癌(HCC)起着重要作用,FXR调控通路也是一个有意义的药物靶点。
本文初步介绍和总结了以BA作为信号传输分子的主要受体FXR,TGR5以及相关的FGF19激素,IBAT转运蛋白的相关背景信息,以及FXR激动剂在治疗NASH/NAFLD的主要药理机制。鉴于最近对人类和小鼠的研究表明, BA信号可能在NAFLD/NASH,以及代谢异常的发生,肝纤维化的进展和消退中起到中心作用, 具体以肝细胞,肠,结肠,BAT或其它组织与BA相关的通路,对应对目标疾病有着巨大的潜力。虽然临床前和现有的临床研究是有希望的, 开发安全有效的基于BA的小分子药物仍然面临许多挑战, 包括FXR/TGR5的选择性和化合物的组织特定活性, 以及副作用和安全问题, 特别是与长期使用此类药物的话。
Intercept Pharmaceuticals, Inc. (ICPT) 于2019年2月19日宣布了治疗 NASH导致肝纤维化的奥贝胆酸,第一个试图治疗NASH的FXR激动剂,达到临床III期终点;但其副作用(OCA 25毫克剂量组):高达51%的患者经历多数是轻度至中度瘙痒事件,5%的患者经历重度瘙痒事件和3%的患者经历胆结石或胆囊炎,比较显著, 同时,患者响应率也不足,例如OCA 25 mg 组的响应率 仅为23.10%。随后,FDA没有批准其加速上市申请。根据各方面的情况以及上述最新数据分析,笔者初步判断OCA仍有机会获得FDA批准上市,即便可能有安全性和副作用的黑框警示,或只能在有限的人群中使用,之类的限制。笔者认为作为FXR激动剂的OCA代表了应对NASH/NAFLD的一个非常重要的信号通路和对于代谢调控的药理机制,其批准上市能够起到非常积极的作用,使得制药厂商更有动力来开发疗效更好,副作用和毒性更低的FXR激动剂;因为,根据已有的数据和知识,似可推测,除脂肪/糖代谢紊乱之外,BA的过度产生和淤积,可能是NASH/NAFLD,进展至纤维化,肝硬化,以至肝癌(HCC),等,的一个重要诱因。为了进一步证实这个实用假设(working hypothesis),也需要发现和开发活性更高,副作用更小的FXR激动剂。
虽然目前骚痒的发病机制尚未完全阐明,但是,笔者怀疑所有小分子FXR激动剂,如同其天然配体胆汁酸一样,都具有骚痒这个可恶的副作用。因此,类似FGF19的生物药很可能是目前已知的,通过调控胆汁酸代谢而对NASH显示临床疗效的最优选择,而不只是之一。因此,笔者认为制药界的同行应当把目光投向生物药,即成熟的,基于蛋白质的生物药,特别是基于FGF19/21的生物药。生物药,以其安全性和有效性,靶标的特异性,较低的副作用,已经在市场上极好的证明了自己。相关生产技术,相比于小分子药物,也越来越成熟;已经不是药物开发的瓶颈。相信有不少 NASH 生物药,特别是基于FGF21的生物药,已在发现和临床前开发阶段。最近,Efruxifermin (Fc-FGF21融合蛋白) 的临床数据十分振奋人心。此外,笔者感觉干预BA信号通路的,特别是以FGF19为代表的生物药,在未来治疗NASH/NAFLD 以及相关代谢综合症,甚至可能在治疗其它肝脏疾病,如PBC和PSC,以及预防肝硬化和肝癌(HCC)方面,可能是的我们的工具箱中的一个极其重要的,甚至不可或缺的工具。当然,最终裁决只能基于临床数据;这里,恐怕只能寄希望于仅有的FGF19类似物,即来自NGM公司的Aldafermin,的后续临床研究,能否提供更多相关数据和洞见。就让吾等拭目以待,以时间和临床数据作为最终的裁决吧。
后续笔者将继续关注NASH生物药的进展并分享个人的思考,盼与同行和同道相互切磋,共同推进NASH药物的研发。
本文如有疏漏和误读相关指南和数据的地方,请读者评论和指正。所有引用的原始信息和资料均来自已经发表学术期刊, 官方网络报道, 等公开渠道, 不涉及任何保密信息。参考文献的选择考虑到多样化但也不可能完备。欢迎读者提供有价值的文献及其评估。
3.
8. GS-0976Ⅱ期临床试验结果喜人,非酒精性脂肪性肝炎后续有药?2017-12-01 云水道人 药事纵横
10. 失败了的CENTAUR Study意味着什么:Cenicriviroc治疗NASH 导致的肝脏纤维化两年的临床IIb期研究结果 2017-09-25 无为杂家 药时代/Drug Times
1. FDA, DRAFT GUIDANCE:Noncirrhotic Nonalcoholic Steatohepatitis With Liver Fibrosis: Developing Drugs for Treatment Guidance for Industry.https://www.fda.gov/regulatory-information/search-fda-guidance-documents/noncirrhotic-nonalcoholic-steatohepatitis-liver-fibrosis-developing-drugs-treatment
2. Alkhouri, N. and A. Scott, An Update on the Pharmacological Treatment of Nonalcoholic Fatty Liver Disease: Beyond Lifestyle Modifications. Clinical liver disease, 2018. 11(4): p. 82-86.
3. Neuschwander-Tetri BA, Loomba R, Sanyal AJ, et al. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial. Lancet 2015;385(9972):956–965.
4. Arab, J., et al., Bile acids and nonalcoholic fatty liver disease: Molecular insights and therapeutic perspectives. Hepatology (Baltimore, Md.), 2017. 65(1): p. 350-362.
5. Taub R et al., “Lipid lowering in healthy volunteers treated with multiple doses of MGL-3196, a liver-targeted thyroid hormone receptor-beta agonist”, Atherosclerosis.230 (2):373–80, 2013
6. Song Y et al, “Thyroid hormone action in metabolic regulation”, Protein Cell, 2(5): 358–368, 2011
7. Araki, O et al., “Distinct dysregulation of lipid metabolism by unliganded thyroid hormone receptor isoforms”, Mol Endocrinol 23, 308–315, 2009
8. Marino L et al., “Endocrine causes of nonalcoholic fatty liver disease”, World J Gastroenterol 21(39): 11053-11076, 2015
9. Copple BL, Li T. Pharmacology of bile acid receptors: Evolution of bile acids from simple detergents to complex signaling molecules. Pharmacol Res 2015;104:9-21.
10. Adams AC et al., “Thyroid hormone regulates hepatic expression of fibroblast growth factor 21 in a PPAR��-dependent manner,” Journal of Biological Chemistry, 2010,285 (19), 14078–14082
11. Ayers S et al., “Thyroid hormone analogues: their role in treatment of hyperlipidemia”, J Endocrinol Diabetes Obes 2(3): 1042-1053, 2014
12. Chung GE et al., “Non-alcoholic fatty liver disease across the spectrum of hypothyroidism,” Journal of Hepatology, vol. 57(1), 150–156, 2012.
13. Caligiuri,A,Molecular Pathogenesis of NASH.Int. J. Mol. Sci. 2016, 17 (9), 1575
14. Mehal W, Cell Death and Fibrogenesis. Semin Liver Dis. 2010 August ; 30(3): 226–231.
15. Diehl AM, et al., Cause, Pathogenesis, and Treatment of Nonalcoholic Steatohepatitis. N Engl J Med 2017; 377:2063-72. DOI: 10.1056/NEJMra1503519
16. Dawson PA, Karpen SJ. Intestinal transport and metabolism of bile acids. J Lipid Res 2015;56:1085-1099.
17. Chiang JY. Bile acid metabolism and signaling. Compr Physiol 2013;3:1191-1212.
18. Lee YA, et al, Pathobiology of liver fibrosis: a translational success story. Gut. 2015 May ; 64(5): 830–841.
19. Fiorucci S, Rizzo G, Antonelli E, et al. A farnesoid x receptor-small heterodimer partner regulatory cascade modulates tissue metalloproteinase inhibitor-1 and matrix metalloprotease expression in hepatic stellate cells and promotes resolution of liver fibrosis. J Pharmacol Exp Ther 2005;314:584-95.
20. Fiorucci S, Antonelli E, Rizzo G, et al. The nuclear receptor SHP mediates inhibition of hepatic stellate cells by FXR and protects against liver fibrosis. Gastroenterology 2004;127:1497-512.
21. Friedman SL. Mechanisms of Hepatic Fibrogenesis. Gastroenterology. 2008 May; 134(6): 1655–1669
22. Roth, J., et al., ob/ob INT-767 improves histopathological features in a diet-induced mouse model of biopsy-confirmed non-alcoholic steatohepatitis. World journal of gastroenterology, 2018. 24(2): p. 195-210.
23. Hodge RJ, Nunez DJ. The therapeutic potential of TGR5 agonists. Hope or hype? Diabetes Obes Metab 2016;18:439-443.
24. Lawitz, E. J., et al. “MET409, an optimized farnesoid X receptor agonist, decreased liver fat and improved liver enzymes in patients with non-alcoholic steatohepatitis: a 12-week, randomized, placebo-controlled study.” The Digital International Liver Congress™, August 27-29, 2020.

游方和尚,医药行业从业者。少小离家,异地求学。稍长即负笈欧美, 走遍美国的东南西北。仿佛追求开悟得道的云水僧人,秉持尼采“生命是获取知识的工具” 之信念,以发现与传播知识谋生,不亦乐乎? ! 与生物制药小编千里有“缘”, 愿与团队里的高人雅士相携参“禅”悟“道”: 参透新医药研发奥秘之“禅”,悟得中华民族复兴之“道”。书山有路,学海无涯,借此与各位编友共勉。

大会框架
▼


【“码”上报名,立抢早鸟优惠!通票低至八折!】
Plus
九月“豪”礼钜献,报名即送,先报先得
▼

欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。











 个人中心
个人中心
 我是园区
我是园区




