

为进一步规范仿制药生物等效性研究,我中心组织起草了《奥氮平口崩片生物等效性研究技术指导原则(征求意见稿)》等十一项技术指导原则,现公开征求意见。欢迎各界提出宝贵意见和建议,并请及时反馈给我们。
征求意见时限为自发布之日起1个月。
请将您的反馈意见发到邮箱:renmr@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2020年8月19日
这11个产品分别是:奥氮平口崩片、醋酸阿比特龙片、醋酸钙片、恩替卡韦片、甲磺酸伊马替尼片、卡马西平片、来氟米特片、利伐沙班片、沙库巴曲缬沙坦钠片、碳酸镧咀嚼片、维格列汀片。


奥氮平口崩片生物等效性研究技术指导原则(征求意见稿)
2020年8月
奥氮平口崩片生物等效性研究技术指导原则
一、概述
奥氮平口崩片(Olanzapine Orally Disintegrating Tablets),用于精神分裂症的治疗。主要成份奥氮平在体内消除半衰期较长,年龄、性别及吸烟情况是奥氮平消除半衰期的影响因素。
奥氮平口崩片人体生物等效性研究应符合本指导原则,还应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》、《生物等效性研究的统计学指导原则》等相关指导原则要求。
二、人体生物等效性研究设计
(一)研究类型
采用两制剂、两周期、两序列交叉设计,开展单次给药的空腹及餐后生物等效性研究。
(二)受试人群
健康受试者。
(三)给药剂量
奥氮平口崩片的规格有2.5mg、5mg、10mg、15mg、20mg。基于安全性方面的考虑,建议采用5mg规格开展生物等效性试验。
(四)给药方法
奥氮平口崩片说明书中有两种口服给药方法,一种为:将口崩片放入口中,在唾液中分散并吞咽;另一种为:将口崩片放入一杯水或其他适宜的饮料中(如橘子汁、苹果汁、牛奶或咖啡),待其分散后立即服用。建议采用第一种给药方式开展临床试验,观察并记录口崩片在口中完全崩解的时间及口感等。
(五)血样采集
应设计足够长的生物样品采集时间,以覆盖药物通过肠道并被吸收的时间段。
(六)检测物质
血浆中的奥氮平。
(七)生物等效性评价
受试制剂相比参比制剂的Cmax、AUC0-t和AUC0-∞的几何均值比90%CI在80.00%~125.00%范围内。
奥氮平的消除半衰期较长,可采用AUC0-72hr来代替AUC0-t和AUC0-∞评价制剂间吸收程度的差异。
三、人体生物等效性研究豁免
若同时满足以下条件,可豁免2.5mg、10mg、15mg、20mg规格生物等效性试验:1)5mg规格符合生物等效性要求;2)各规格制剂在不同pH介质中体外溶出曲线相似;3)各规格制剂的处方比例相似。
四、参考文献
1. 国家药品监督管理局. 奥氮平口崩片说明书. 2017.
2. 国家药品监督管理局.《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》. 2016.
3. 国家药品监督管理局.《生物等效性研究的统计学指导原则》. 2018.
4. U.S. Food and Drug Administration. Guidance on Olanzapine. 2008.
5. European Medicines Agency. Guideline on the Investigation of Bioequivalence. 2010.
6. U.S. Food and Drug Administration. Guidance for Industry——Orally Disintegrating Tablets. 2008.
醋酸阿比特龙片生物等效性研究技术指导原则(征求意见稿)
2020年8月
醋酸阿比特龙片生物等效性研究技术指导原则
一、概述
醋酸阿比特龙片(Abiraterone Acetate Tablets)主要用于治疗前列腺癌,主要成份为醋酸阿比特龙。食物对药物的吸收影响较大,本品须在餐前至少1小时和餐后至少2小时空腹服用。
醋酸阿比特龙片生物等效性研究应符合本指导原则,还应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》、《生物等效性研究的统计学指导原则》、《高变异药物生物等效性研究技术指导原则》等相关指导原则。
二、人体生物等效性研究设计
(一)研究类型
建议采用两制剂、单次给药、交叉试验设计,进行空腹人体生物等效性研究。
(二)受试人群
健康男性受试者。
(三)给药剂量
采用申报的最高规格单片服用。
(四)给药方法
口服给药。
(五)血样采集
应合理设计样品采集时间,使其包含吸收、分布及消除相。
(六)检测物质
血浆中阿比特龙。
(七)生物等效性评价
以阿比特龙的Cmax、AUC0-t、AUC0-∞为评价指标,生物等效性接受标准受试制剂与参比制剂的Cmax、AUC0-t、AUC0-∞的几何均值比90%CI在80.00%-125.00%之间。
(八)其他
1. 如若采用重复试验设计,建议参考相关指南。
2. 需告知受试者因目前尚不明确精液中是否会残留阿比特龙或其代谢物,三个月内应无育儿计划,并在研究过程及结束至少一周内需进行避孕。
三、人体生物等效性研究豁免
不适用。
四、参考文献
1. 国家药品监督管理局. 醋酸阿比特龙片(泽珂® /Zytiga®)说明书. 2018.
2. U.S. Food and Drug Administration. Draft Guidance on Abiraterone Acetate. 2018-7.
3. European Medicines Agency. Abiraterone tablets 250 mg and 500 mg product-specific bioequivalence guidance. 2020-5-28.
醋酸钙片生物等效性研究技术指导原则(征求意见稿)
2020年8月
醋酸钙片生物等效性研究技术指导原则
一、概述
醋酸钙片(Calcium Acetate Tablets)为磷结合剂,临床用于慢性肾功能衰竭所致的高磷血症,本指导原则适用于高磷血症适应症的醋酸钙制剂研究。[1]
醋酸钙通过在消化道与食物中的磷酸盐结合成磷酸钙盐沉淀,减少磷酸盐的吸收,从而降低血中磷酸盐浓度。考虑钙为内源性物质,测定干扰因素多、个体差异大,与本适应症相关性小,因而不适合采用药代动力学研究方法评价其生物等效性。本品仿制药研究建议采用体外磷酸盐结合研究和溶出研究以考察受试制剂与参比制剂磷酸盐结合能力的一致性。[2]
二、体外磷酸盐结合研究
(一)研究规格
667mg(相当于169mg钙)。
(二)研究方法
应在至少八种不同的磷酸盐浓度下分别针对受试制剂(T)和参比制剂(R)产品采用合理的条件开展研究并描绘出典型的磷酸盐结合曲线。最高磷酸盐浓度应保证磷酸根完全沉淀(即应实现最大磷酸盐结合)以考察磷酸盐结合能力。应在至少12个制剂单位(T和R)中平行开展磷酸盐结合相关研究,并分别绘制受试制剂和参比制剂的平均磷酸盐结合曲线。计算受试制剂和参比制剂的最大磷酸盐结合量的平均值比(T/R结合比),并分别计算受试制剂和参比制剂磷酸盐结合曲线以及游离钙浓度变化曲线的相似因子(f2)。
(三)检测物质
上清液中的游离钙和游离磷酸盐。
应使用经验证的分析方法进行测定。方法学验证建议参考《中国药典》通则《9101药品质量标准分析方法验证指导原则》和《9012生物样品定量分析方法验证指导原则》
(四)评价指标
受试制剂和参比制剂最大磷酸盐结合量的均值比(T/R结合比)。
(五)判定标准
基于点估计值:T/R结合比的数值应不低于90.00%,且不超过110.00%。
三、溶出研究
除质量标准中规定的溶出方法(该方法用于稳定性和质量控制测定)之外,还应开展以下研究:采用桨法、50转/分钟,分别在0.1N盐酸溶液、pH 4.5醋酸盐缓冲液和pH 6.8硼酸盐缓冲液的溶出介质中,对12个剂量单位的受试制剂和参比制剂进行溶出曲线相似性比较研究。
四、参考文献
1. Paddock Laboratories, LLC. Label for calcium acetate tablet (Perrigo®), [EB/OL]. (2019-4). https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/79b7bbb6-b021-46ab-99a5-cef95472532b/spl-doc?hl=calcium%20acetate.
2. U.S. Food and Drug Administration. Draft Guidance on Calcium Acetate, (2017-5).
恩替卡韦片生物等效性研究技术指导原则(征求意见稿)
2020年8月
恩替卡韦片生物等效性研究技术指导原则
一、概述
恩替卡韦片(Entecavir Tablets)主要用于病毒复制活跃、血清丙氨酸氨基转移酶(ALT)持续升高或肝脏组织学显示有活动性病变的慢性成人乙型肝炎的治疗,主要成份为恩替卡韦。本品迅速吸收,0.5到1.5小时达到峰浓度(Cmax),进食标准高脂餐或低脂餐的同时口服0.5mg本品会导致药物吸收的轻微延迟(从原来的0.75小时变为1.0~1.5小时),Cmax降低44%~46%,药时曲线下面积(AUC)降低18%~20%。因此,本品应空腹服用(餐前或餐后至少2小时)。在达到血浆峰浓度后,血药浓度以双指数方式下降,达到终末消除半衰期约需128~149小时,半衰期较长。
恩替卡韦片生物等效性研究应符合本指导原则,还应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》、《生物等效性研究的统计学指导原则》等相关指导原则。
二、人体生物等效性试验设计
(一)研究类型
建议采用两制剂、两周期、两序列交叉设计,进行空腹人体生物等效性研究。也可以采用平行设计。
(二)受试人群
健康受试者。
(三)给药剂量
建议采用申报的最高规格单片服用。
(四)给药方法
口服给药。
(五)血样采集
合理设计样品采集时间,使其包含吸收、分布及消除相。
(六)检测物质
血浆中恩替卡韦。
(七)生物等效性评价
受试制剂相比参比制剂的Cmax、AUC0-t和AUC0-∞的几何均值比90%CI在80.00%~125.00%范围内。
恩替卡韦的消除半衰期较长,可采用AUC0-72hr来代替AUC0-t和AUC0-∞评价制剂间吸收程度的差异。
三、人体生物等效性研究豁免
若同时满足以下条件,可豁免0.5mg规格制剂的人体生物等效性研究:(1)1mg规格制剂符合生物等效性要求;(2)各规格制剂在不同pH介质中体外溶出曲线相似;(3)各规格制剂的处方比例相似。
四、参考文献
1. 国家药品监督管理局. 恩替卡韦片说明书. 2019.
2. U.S. Food and Drug Administration. 恩替卡韦片说明书. 2019.
3. European Medicines Agency. 恩替卡韦片说明书. 2011.
4. 国家药品监督管理局.《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》. 2016.
5. 国家药品监督管理局.《生物等效性研究的统计学指导原则》. 2018.
6. U.S. Food and Drug Administration. Guidance on Entecavir. May 2008.
7. European Medicines Agency. Entecavir film-coated tablets 0.5 and 1 mg, oral solution 0.05 mg/mL product-specific bioequivalence guidance. November 2016.
甲磺酸伊马替尼片生物等效性研究技术指导原则(征求意见稿)
2020年8月
甲磺酸伊马替尼片生物等效性研究技术指导原则
一、概述
甲磺酸伊马替尼片(Imatinib Mesylate Tablets)用于治疗费城染色体阳性的慢性髓性白血病(Ph+ CML)的慢性期、加速期或急变期;用于治疗不能切除和/或发生转移的恶性胃肠道间质瘤(GIST)的成人患者;联合化疗治疗新诊断的费城染色体阳性的急性淋巴细胞白血病(Ph+ ALL)的儿童患者;用于治疗复发的或难治的费城染色体阳性的急性淋巴细胞白血病(Ph+ ALL)的成人患者,主要成份为甲磺酸伊马替尼。为降低胃肠道紊乱风险,甲磺酸伊马替尼片应在进餐时服用。
甲磺酸伊马替尼片生物等效性研究应符合本指导原则,还应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》、《生物等效性研究的统计学指导原则》等相关指导原则。
二、人体生物等效性研究设计
(一)研究类型
采用两制剂、两周期、两序列交叉设计,进行餐后条件下单次给药的人体生物等效性研究。
(二)受试人群
健康受试者。
(三)给药剂量
建议采用申报的最高规格单片服用。
(四)给药方法
口服给药。
(五)血样采集
合理设计样品采集时间,使其包含吸收、分布及消除相。
(六)检测物质
血浆中伊马替尼。
(七)生物等效性评价
以伊马替尼的Cmax、AUC0-t、AUC0-∞为评价指标,生物等效性接受标准受试制剂与参比制剂的Cmax、AUC0-t、AUC0-∞的几何均值比90%CI在80.00%-125.00%之间。
三、人体生物等效性研究豁免
若同时满足以下条件,可豁免100mg规格的人体生物等效性研究:1.400mg规格制剂符合生物等效性要求;2.各规格制剂在不同pH介质中体外溶出曲线相似;3.各规格制剂的处方比例相似。
四、参考文献
1. 国家药品监督管理局. 甲磺酸伊马替尼片(格列卫®/Glivec®)说明书. 2017.
2. U.S. Food and Drug Administration. Draft Guidance on Imatinib Mesylate. 2014-7.
3. European Medicines Agency. Imatinib hard capsules 50 and 100 mg, film-coated tablets 100 and 400 mg product-specific bioequivalence guidance. 2020-5-28.
卡马西平片生物等效性研究技术指导原则(征求意见稿)
2020年8月
卡马西平片生物等效性研究技术指导原则
一、概述
卡马西平片(Carbamazepine Tablets)用于治疗癫痫和三叉神经痛,主要成份为卡马西平。卡马西平是窄治疗指数药物,其有效浓度与中毒浓度接近;偏离最佳剂量或浓度会导致治疗失败或严重毒性;临床应用中需要基于药动学指标进行治疗药物监测;具有中低程度的个体内变异。
卡马西平片生物等效性研究应符合本指导原则,还应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》、《生物等效性研究的统计学指导原则》和《窄治疗窗药物生物等效性研究技术指导原则》等相关指导原则。
二、人体生物等效性研究设计
(一)研究类型
建议采用完全重复(两制剂、四周期、两序列)交叉设计,进行空腹和餐后人体生物等效性研究。
(二)受试人群
健康受试者。
(三)给药剂量
建议采用申报的最高规格单片服用。
(四)给药方法
口服给药。
(五)血样采集
合理设计样品采集时间,使其包含吸收、分布及消除相。
(六)检测物质
血浆中卡马西平。
(七)生物等效性评价
采用参比制剂标度的平均生物等效性(Reference-scaled average bioequivalence,RSABE)方法进行生物等效性评价,等效性判定标准参照《窄治疗窗药物生物等效性研究技术指导原则》。
三、人体生物等效性研究豁免
若同时满足以下条件,可豁免100mg规格制剂的人体生物等效性研究:(1)200mg规格制剂符合生物等效性要求;(2)各规格制剂在不同pH介质中体外溶出曲线相似;(3)各规格制剂的处方比例相似。
四、参考文献
1.国家药品监督管理局.卡马西平片说明书.2018
2.国家药品监督管理局.以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则.2016.
3.国家药品监督管理局.生物等效性研究的统计学指导原则.2018.
4.国家药品监督管理局.窄治疗指数药物生物等效性研究技术指导原则(征求意见稿).2020
5.U.S. Food and Drug Administration.Draft Guidance on Carbamazepine. Sept 2015.
6.U.S. Food and Drug Administration.Draft. Draft Guidance on Warfarin Sodium. Dec 2012.
来氟米特片生物等效性研究技术指导原则(征求意见稿)
2020年8月
来氟米特片生物等效性研究技术指导原则
一、概述
来氟米特片(Leflunomide Tablets)用于治疗类风湿关节炎、银屑病关节炎和狼疮性肾炎,主要成份为来氟米特。本品具有半衰期长,潜在的胚胎-胎儿毒性和肝毒性,停药需加速清除等特点。
来氟米特片生物等效性研究应符合本指导原则,还应参照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》、《生物等效性研究的统计学指导原则》等相关指导原则。
二、人体生物等效性研究设计
(一)研究类型
开展单次给药的空腹及餐后生物等效性研究,可采用两制剂、两周期、两序列交叉试验设计。
由于来氟米特的活性代谢产物特立氟胺(检测物质)的半衰期较长,也可考虑采用平行试验设计。
(二)受试人群
健康成年男性,同时应排除在研究过程中有生育计划的男性受试者。
(三)给药剂量
建议采用申报的最高规格单片服用。
(四)给药方法
口服给药。
(五)血样采集
因来氟米特的活性代谢产物特立氟胺的消除半衰期较长,需设计足够长的生物样品采集时间,以覆盖药物通过肠道并被吸收的时间段。
若采用平行试验设计,在论证药物分布和清除个体内变异较小的前提下,可用AUC0-72hr代替AUC0-t或AUC0-∞,即采集0~72h的血样。
(六)检测物质
血浆中特立氟胺。
(七)生物等效性评价
生物等效性接受标准为受试制剂相比参比制剂的Cmax和AUC的几何均值比90%置信区间在80.00%-125.00%范围内。
(八)其他考虑
由于特立氟胺的半衰期较长,且存在潜在的胚胎-胎儿毒性和肝毒性,基于受试者安全和伦理保护的考虑,建议申办者和研究者参考原研说明书相关要求,采用必要的药物清除程序(如使用考来烯胺或活性炭等)消除受试者体内残存的特立氟胺,降低可能的安全风险。
三、人体生物等效性研究豁免
若同时满足以下条件,可豁免10mg规格制剂的人体生物等效性研究:1)20mg规格制剂符合生物等效性要求;2)各规格制剂在不同pH介质中体外溶出曲线相似;3)各规格制剂的处方比例相似。
四、 参考文献
1.国家药品监督管理局.《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》. 2016.
2.国家药品监督管理局.《生物等效性研究的统计学指导原则》. 2018.
3. U.S. Food and Drug Administration. ARAVA说明书.2016.
4. U.S. Food and Drug Administration.Draft Guidance on Leflunomide. Nov 2004.
利伐沙班片生物等效性研究技术指导原则(征求意见稿)
2020年8月
(一)研究类型
(二)受试人群
(三)给药剂量
(四)给药方法
(五)血样采集
(六)检测物质
(七)生物等效性评价
(一)溶出研究
(二)磷酸盐结合研究
1. 动力学结合研究
2. 平衡结合研究
3. 检测物质
4. 评价指标
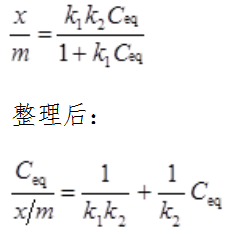
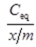 为纵坐标(Y),进行线性回归,得到线性方程。从斜率(a)和截距(b)可计算k1和k2:
为纵坐标(Y),进行线性回归,得到线性方程。从斜率(a)和截距(b)可计算k1和k2:

5. 生物等效性判定
(一)体外研究的豁免要求
(二)体内研究的豁免要求
华阳制药




 个人中心
个人中心
 我是园区
我是园区




