▎药明康德内容团队报道
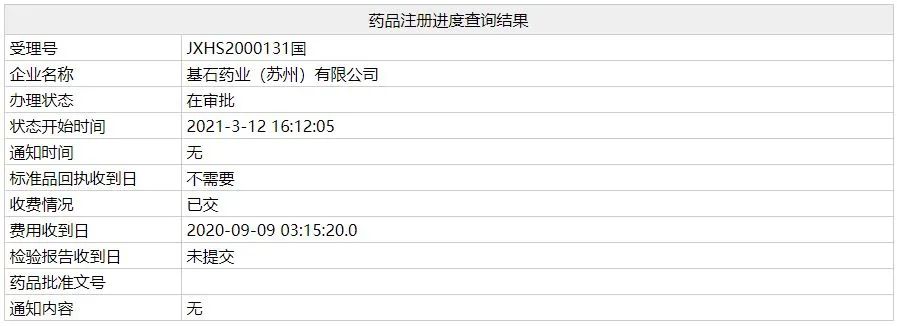
中国国家药监局(NMPA)药品注册进度查询结果最新公示,基石药业申报的RET抑制剂普拉替尼(pralsetinib)新药上市申请(NDA)审评审批状态已更新为:在审批。公开资料显示,该药本次申请的适应症为既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。值得一提的是,如果该药获批,它将有望成为中国首个获批的RET抑制剂。
普拉替尼是Blueprint Medicines开发的一款强效、高选择性靶向致癌性RET变异(包括可预见的耐药突变)的口服精准疗法,基石药业于2018年6月获得了该产品在大中华区的独家开发和商业化授权。
在美国,该药已被FDA批准用于治疗转移性RET融合阳性NSCLC的成人患者、需要系统性治疗的晚期或转移性RET突变甲状腺髓样癌成人和12岁及以上儿童患者,以及需要系统性治疗且放射性碘难治(如适用)的晚期或转移性RET融合阳性甲状腺癌成人和12岁及以上儿童患者。
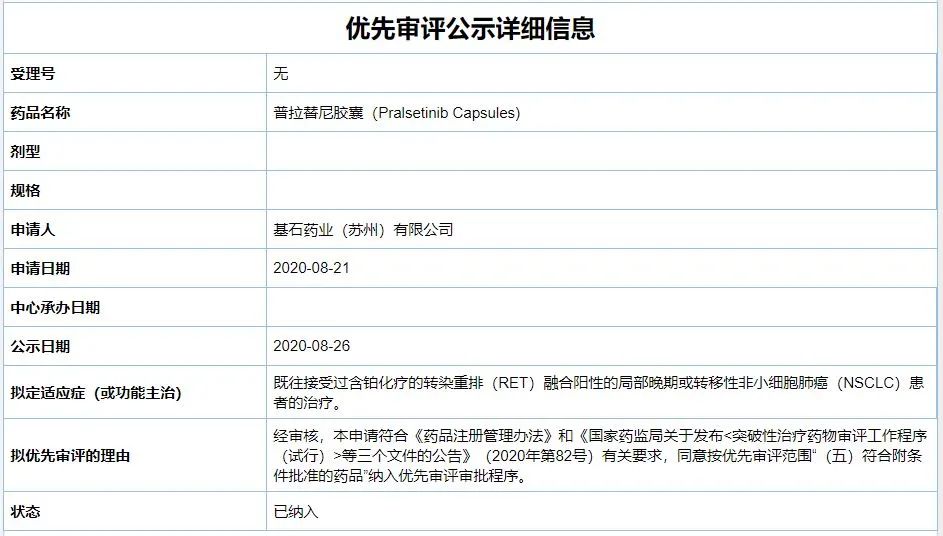
在中国,普拉替尼的上市申请于2020年8月被中国国家药监局药品审评中心(CDE)纳入优先审评,拟用于既往接受过含铂化疗的转染重排(RET)融合阳性的局部晚期或转移性NSCLC患者的治疗。
根据公开资料,普拉替尼的这项上市申请是基于一项开放标签、多中心的全球性1/2期临床试验,该研究旨在评估普拉替尼在RET融合阳性NSCLC的晚期实体瘤患者中的安全性、耐受性和有效性。研究数据显示,普拉替尼在经含铂化疗的RET融合阳性的NSCLC中国患者中显示出了优越和持久的抗肿瘤活性,总体缓解率(ORR)为56%,安全性及耐受性良好,未出现与普拉替尼相关的不良事件导致的终止治疗或死亡。
值得一提的是,2020年9月,普拉替尼已成功引入海南博鳌乐城国际医疗旅游先行区。本次普拉替尼的申请进入「在审批」意味着,该药将有望很快惠及更多的中国患者。
2020年6月,燃石医学已与基石药业达成伴随诊断(CDx)战略合作,双方将携手开发和商业化普拉替尼在中国地区的CDx试剂,用于检测肿瘤患者的RET基因变异。2021年3月,基石药业还与国药控股签署战略合作协议,
携手推进包括普拉替尼在内的两款癌症精准治疗药物在中国获批上市后的商业化进程。
除了经含铂化疗的RET融合阳性的NSCLC患者,普拉替尼还有更多的治疗潜力,包括:未经含铂化疗的RET融合阳性NSCLC、RET突变阳性的晚期或转移性甲状腺髓样癌(MTC)患者等等。其中,普拉替尼用于RET突变阳性的晚期或转移性MTC患者系统性治疗的申请已于2020年12月被CDE纳入突破性治疗品种。
期待普拉替尼的这些临床试验也顺利进行,早日为更多患者带来新的治疗选择。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医药观澜」微信公众号留言联系我们。
欢迎扫码关注
“
医药观澜
”微信公众号
,了解更多中国医药创新动态。

注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料
[1]中国国家药监局(NMPA)官网. From https://www.nmpa.gov.cn/zwfw/zwfwzhcx/index.html
[2]中国国家药监局药品审评中心(CDE). From http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20








 个人中心
个人中心
 我是园区
我是园区




