
这款CAR-T疗法于2021年3月28日在美国获FDA加速批准上市,成为美国FDA批准的首个靶向BCMA的CAR-T细胞治疗。2021年6月25日,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)发布一份积极审查意见,建议有条件批准Abecma用于治疗复发性和难治性多发性骨髓瘤。
推荐阅读:
有条件的上市许可是为了满足标准治疗失败的患者的未满足需求而授予的,欧盟有条件的上市许可最初有效期为一年,可以在提交和评估其他确认数据后延长或转换为完整的上市许可。
在欧洲,每年有近50,000人被诊断出患有多发性骨髓瘤(MM)。尽管近年来多发性骨髓瘤的免疫治疗方案取得了进步,发展了包括免疫调节剂、蛋白酶体抑制剂和抗CD38抗体在内的治疗方案,但MM仍然是一种无法治愈的疾病,许多患者经历了缓解后复发的过程。临床上,经历过三种以上主要药物类别治疗的复发性和难治性多发性骨髓瘤患者剩余的治疗选择很少。
Abecma是一种B细胞成熟抗原(BCMA)靶向的嵌合抗原受体(CAR)T细胞免疫疗法,通过识别并与多发性骨髓瘤细胞表面的BCMA结合,导致CAR-T细胞增殖、细胞因子分泌和随后的BCMA表达细胞的细胞溶解杀伤。

▲Abecma(图片来源:businesswire)
了解更多详情,扫描二维码进行完整阅读


另外,接受Abecma治疗的184例患者的安全性分析汇集在KarMMa和CRB-401研究中,81%的患者发生了细胞因子释放综合征(CRS),9%的患者CRS≥3级。Abecma的安全性与已确立的特征相符。无论患者既往接受过多少种方案,疗效和安全性数据相似。
“欧共体批准Abecma是治疗多发性骨髓瘤的一个重要里程碑,使我们更接近于为欧洲患者提供一流的个性化治疗,在用尽三个标准的先前治疗方案后与这种不治之症作斗争护理,”BMS首席医疗官Samit Hirawat博士说,“有了Abecma在全球的第三次监管批准,我们很自豪能够推进细胞疗法的科学发展,并继续将这种BCMA靶向的CAR-T细胞疗法带给有需要的患者。”

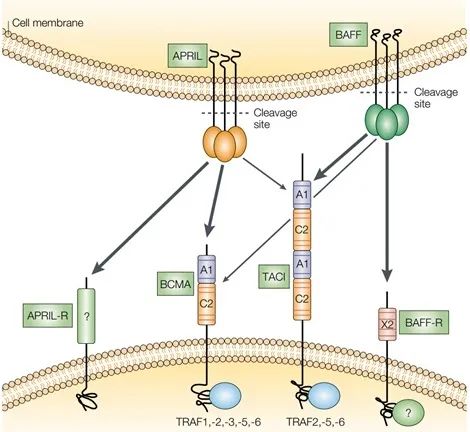
BCMA靶点开启CAR-T细胞治疗新赛道
推荐阅读:药明巨诺靶向BCMA CAR-T申报临床丨医麦猛爆料
除此之外,国内研究BCMA靶向CAR-T疗法的南京驯鹿、科济生物、恒润达生、普瑞金等公司也顺利进入临床试验阶段,另外亘喜生物、西比曼生物、艺妙神州、博生吉等公司也早有类似管线布局(不完全统计)。
参考资料:
1.https://www.biospace.com/article/releases/bristol-myers-squibb-receives-european-commission-approval-for-abecma-idecabtagene-vicleucel-the-first-anti-bcma-car-t-cell-therapy-for-relapsed-and-refractory-multiple-myeloma/
2.https://zhuanlan.zhihu.com/p/148603143


 点击“阅读原文”,立即报名!
点击“阅读原文”,立即报名!



 个人中心
个人中心
 我是园区
我是园区






