

自1970年代Köhler和Milstein开发能够产生单克隆抗体(mAb)的杂交瘤技术以来,mAb已成为治疗癌症和免疫疾病的关键药物,2021年第100种基于抗体的治疗药物已获得美国食品和药物管理局(FDA)批准。
然而,尽管利用抗体对抗传染病的历史可以追溯到一个多世纪以前的血清应用,但只有少数mAb药物用于治疗或预防传染病。截至2022年初,已有6种针对病原体的mAb已获得FDA批准(表1),适应症包括预防呼吸道合胞病毒(RSV)感染、预防和治疗炭疽感染、预防艰难梭菌感染复发和治疗埃博拉病毒(EBOV)感染。
表1:FDA批准的用于传染病适应症的mAb

2020年,COVID-19的迅速传播使研究人员大力开发针对SARS-CoV-2的中和mAb。现阶段,超过20种mAb进入临床开发阶段,其中一些mAb已获得FDA和全球其他机构的EUA(表2)。尽管疫苗一直是应对COVID-19的主力军,但mAb也有一定贡献,特别是针对免疫功能低下或有轻度至中度COVID-19的患者。


人类mAb治疗病原体的策略可分为靶向已知抗原和靶向未知抗原(图2)。靶向已知抗原的mAb从噬菌体展示文库中筛选,该文库由免疫或感染个体的免疫球蛋白可变基因构建。尽管这些方法已分离出针对多种病原体(例如HIV29、SARS-CoV-2和炭疽毒素)的中和抗体,但筛选出的mAb并不代表天然抗体库。
随后开发的第二种靶向方法,是直接分离抗原特异性记忆B细胞,然后识别它们产生的mAb。记忆B细胞可以来自恢复期患者的血浆,或来自携带人类免疫球蛋白基因座的转基因小鼠。
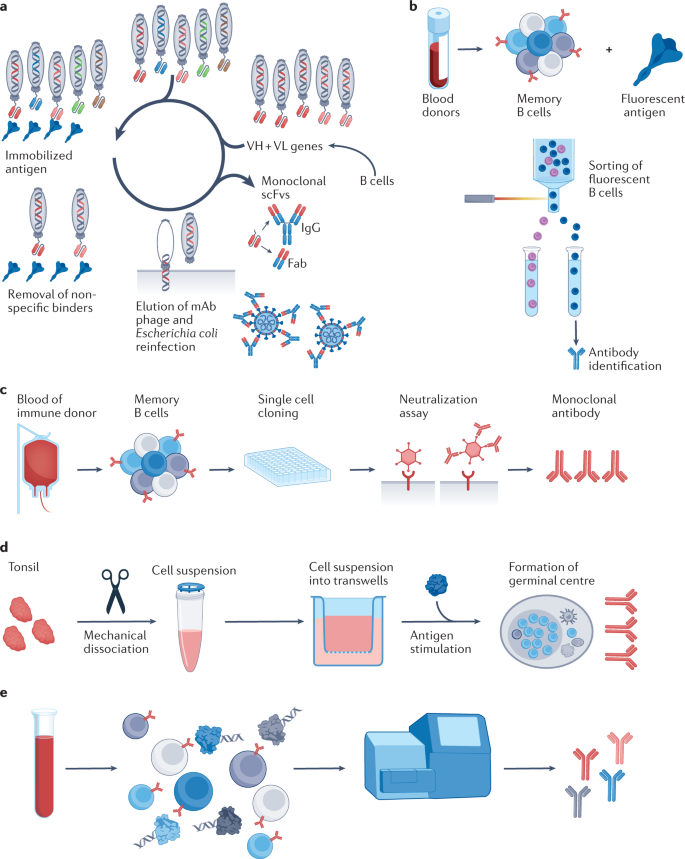 图2:抗体的发现方法
图2:抗体的发现方法

冠状病毒是冠状病毒科有包膜的正义单链RNA病毒,可以感染多种哺乳动物和鸟类,导致呼吸道和/或肠道疾病。人类冠状病毒是引起普通感冒的主要原因,导致人类约30%的轻度呼吸道感染和非典型肺炎。4种不同的冠状病毒通常在人群中传播,包括HCoV-OC43、HCoV-HKU1、HCoV-NL63和HCoV-229E。
在过去的二十年中,出现了3种可能导致人类生命危险疾病的冠状病毒。严重急性呼吸综合征冠状病毒(SARS-CoV)于2002年在中国出现并传播,在37个国家造成8100人感染和近800人死亡。十年后,中东呼吸综合征冠状病毒(MERS-CoV)在阿拉伯半岛出现,并传播到21个国家,感染约2500人,致死率为35%。2019年,在中国发现了一种现在称为SARS-CoV-2的冠状病毒感染,这种冠状病毒可导致发烧、严重的呼吸道疾病、肺炎、腹泻、呼吸困难和多器官衰竭。根据世界卫生组织(WHO)的数据,截至2022年2月,已确认超过4.14亿例病例,导致至少580万人死亡。
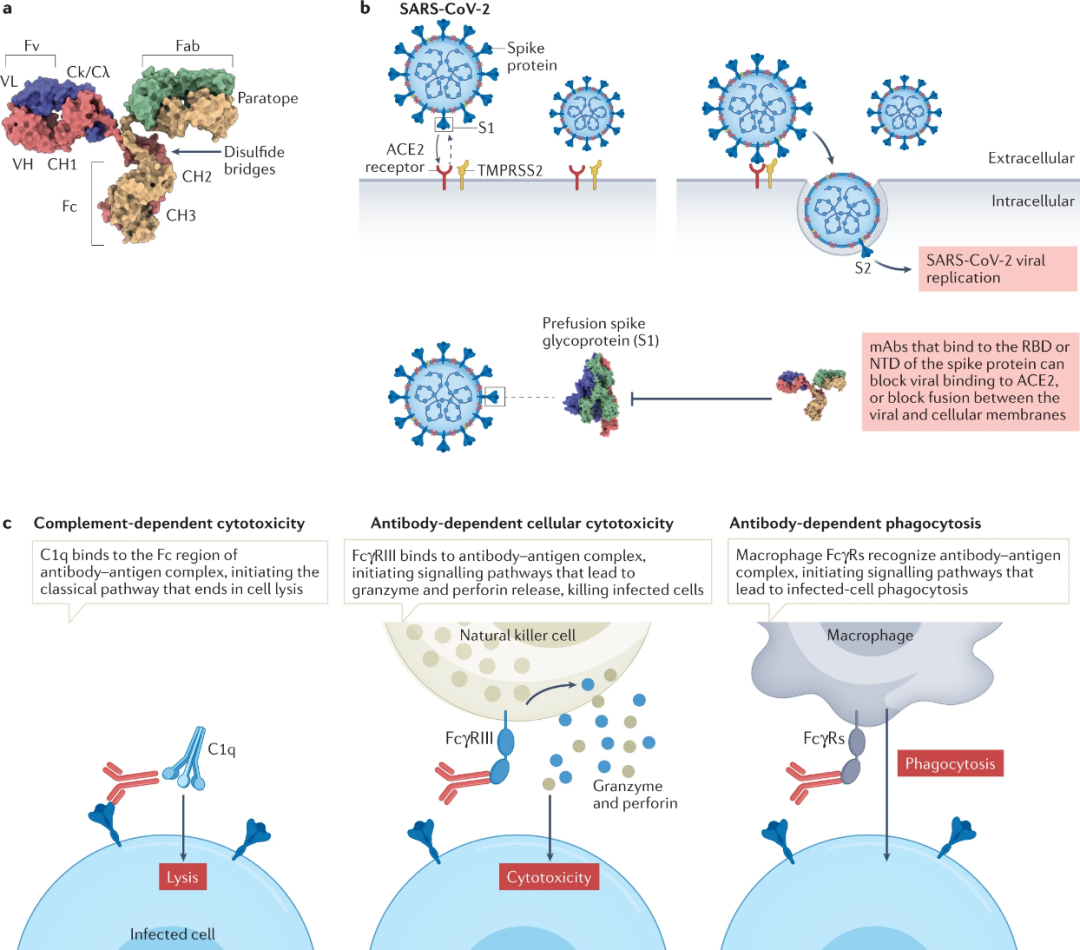
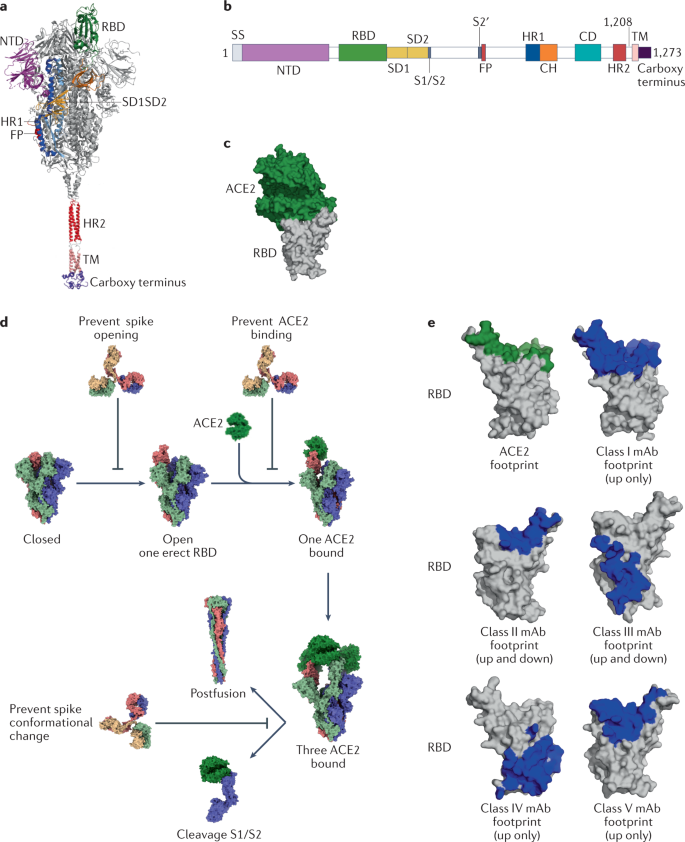
所有冠状病毒都使用三聚体刺突(S)跨膜糖蛋白进入宿主细胞。S蛋白是一种I型膜I类融合蛋白,其有两个功能亚基,它们在蛋白质融合前构象中保持非共价结合(图3a)。氨基末端S1亚基负责与宿主细胞受体结合,而羧基末端S2亚基负责融合病毒和细胞膜。S1亚基进一步分为N端结构域(NTD)和RBD(图3a)。
SARS-CoV-2的基因组序列与SARS-CoV有79.6%的同一性,并且与SARS-CoV相似,依靠S1亚基RBD与宿主细胞(如肺细胞和肠细胞)上的ACE2受体结合。在与宿主细胞结合后,S2亚基构象变化导致病毒融合并进入靶细胞(图3b)。
S糖蛋白一直是开发靶向SARS-CoV-2mAb的焦点蛋白,它是针对SARS-CoV和MERS-CoV的有效中和mAb靶标。超过20种靶向S糖蛋白的mAb已进入临床试验,其中一些已获得FDA批准(表2)。
然而,迄今为止针对COVID-19治疗的大多数mAb会因为SARS-CoV-2变体(VOC)的迅速出现而治疗受限。诸如Alpha、Beta、Gamma和Delta等VOC在S糖蛋白区域有9-12个突变,这些突变会影响mAb的治疗性。
Omicron变体在S糖蛋白中累积超过35个突变,其中15个发生在RBD中,RBD不仅是与宿主受体ACE2结合的位点,也是治疗性mAb的关键靶点。Omicron VOCs(BA.1、BA.1.1和BA.2)的出现使许多mAb失效,包括casirivimab和imdevimab的联合使用、bamlanivimab和etesevimab的联合使用以及sotrovimab(表2)。不过,最近开发的两种mAb,bebtelovimab和P2G3对OmicronVOC依然能保持活性。
S蛋白上的NTD结构域也是一个重要靶点(图3a),NTD特异性抗体的结构表征表明mAb靶向NTD突出区域的上侧。41个NTD特异性mAb的表位作图鉴定了6个抗原位点,其中一个被所有已知NTD特异性中和抗体识别,并被称为“NTD超位点”,由残基14-20、140-158和245–264组成,目前NTD特异性抗体起作用的中和机制仍有待确定。
确定使用mAb治疗的目标人群和最佳时机至关重要。mAb被认为在具有严重COVID-19高风险的个体中发挥预防作用,如老年人和/或患有多种疾病的个体,以及对疫苗接种反应不佳或免疫功能低下的个体。
最后,尽管最初担心抗SARS-CoV-2mAb会引起ADE风险,但目前没有证据表明在临床试验中任何mAb都会发生ADE。
RSV是一种有包膜的负链RNA病毒,属于肺病毒科。RSV感染极为常见,通常会导致轻微的呼吸道症状。
1990年代末至2000年代初,第一个名为RespiGam的RSV静脉注射免疫球蛋白制剂被用于预防患有支气管肺发育不良和早产幼儿的严重RSV相关下呼吸道疾病。RespiGam于2003年停止使用,取而代之的是帕利珠单抗预防,帕利珠单抗也是第一个用于治疗高危婴儿严重RSV感染的中和mAb,于1998年获批。
在三种RSV表面蛋白(F、G和SH)中,F特异性抗体在受感染的人类血清中具有中和活性,因此F糖蛋白一直是RSV单克隆抗体开发的重点。F糖蛋白是负责将病毒膜与细胞膜融合的三聚体I型融合糖蛋白,与许多其他病毒融合糖蛋白类似。
帕利珠单抗是一种人源化mAb,可与F糖蛋白的抗原位点II结合(图4a)。Motavizumab是一种亲和力高的帕利珠单抗衍生物,效力高10倍,与帕利珠单抗相比,其RSV住院率相对降低了26%。然而,2010年III期临床试验的结果显示,与帕利珠单抗相比,Motavizumab不良事件增加,导致其开发终止。
用于治疗RSV的新型mAb,例如nirsevimab(MEDI8897)和suptavumab(REGN2222),Nirsevimab衍生自一种名为D25的mAb,由AIMM Therapeutics分离,靶向抗原位点Ø,在体外比帕利珠单抗更有效。
埃博拉病毒是属于丝状病毒科的单链RNA病毒。埃博拉病毒属包含6种不同名称:本迪布焦埃博拉病毒(Bundibugyovirus)、雷斯顿埃博拉病毒(Restonvirus)、苏丹埃博拉病毒(Sudanvirus)、塔伊森林埃博拉病毒(TaïForestvirus)、邦巴里埃博拉病毒(Bombalivirus)和扎伊尔埃博拉病毒(埃博拉病毒,EBOV)。EBOV会导致严重疾病,病死率高达25-90%。
EBOV的糖蛋白是三聚体I类融合蛋白,由三个二硫键连接的GP1-GP2异二聚体在病毒表面形成三聚体。GP1亚基与EBOV受体NPC1结合,允许GP2介导的病毒和宿主细胞膜融合(图4b)。GP1带有RBS、聚糖帽和粘蛋白样结构域。GP2包含一个N端肽、内部融合环和跨膜结构域。
1995年从埃博拉病毒幸存者中分离出两种mAb(mAb100和mAb114),REGN-EB3(以Inmazeb销售,再生元)是三种针对EBOV糖蛋白的完全人源mAb(REGN3470、REGN3479和REGN3471)的组合。REGN3479(现称为maftivimab)识别GP2融合环并提供中和活性,REGN3471(现称为odesivimab)识别外部聚糖帽并具有细胞靶向功能。REGN3470(现在称为atoltivimab)与GP1头部结合,提供中和活性和细胞靶向活性。
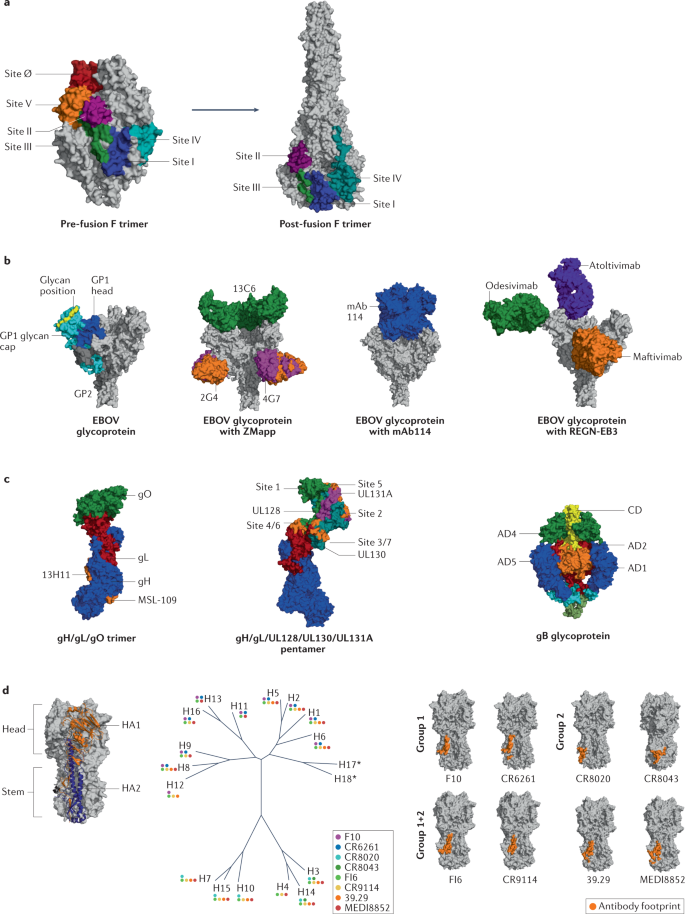
HCMV利用不同的糖蛋白复合物允许细胞进入多种细胞。两种含gH / gL的复合物可调节病毒嗜性,gH / gL / gO三聚体与PDGFRα结合,是成纤维细胞感染所必需,gH / gL / UL128 / UL130 / UL131A五聚体与神经纤维蛋白2结合,是病毒进入上皮细胞、内皮细胞和骨髓细胞所必需的。(图4c)。
几种靶向gH / gL或gB复合物的mAb已被分离出来,并在体外感染模型中显示出适度的功效。为了鉴定最有效的HCMV中和抗体,Lanzavechia小组从自然感染供体的记忆B细胞中分离出一大组mAb,发现五聚体复合体是HCMV中和的主要靶点,其产生的中和抗体的效力比其他HCMV复合体的效力大几个数量级。这一发现揭示了抗原选择对鉴定有效的中和mAb和设计有效疫苗的重要性。
在同种异体造血干细胞移植或实体器官移植后,使用HCMV特异性mAb预防HCMV感染和疾病已得到广泛研究。MSL-109是一种靶向HCMV表面糖蛋白gH的mAb,且作为AIDS患者的HCMV诱导性视网膜炎的补充治疗,但由于缺乏疗效,在II/III期停止开发。RG7667是结合gH / gL和五聚体复合物的两种mAb的混合物,可以有效地中和所有测试细胞类型的HCMV感染。然而,在对肾移植受者进行的II期试验评估时,发现缺乏疗效。CSJ148由两种抗HCMV mAb组成,一种抗gB mAb(LJP538)和一种抗五聚体 mAb(LJP539),用于预防造血干细胞移植患者的HCMV,也终止于II期试验。
因此,尽管抗HCMV mAb已做出了重大开发努力,但尚未获得FDA批准。临床上唯一可用的基于抗体的疗法仍然是Cytogam,一种用于静脉注射的CMV免疫球蛋白制剂。
流感是正粘病毒科的一员,有4种类型——甲型、乙型、丙型和丁型流感——它们都有一个分段的负义单链RNA基因组。甲型和乙型流感是造成人类严重感染的原因,而丙型流感仅引起轻微症状,丁型流感不会感染人类。该病毒基因组由编码至少12种蛋白质的8个片段组成:血凝素(HA)、神经氨酸酶(NA)、PB2、PB1、PB1-F2、PA、PA-X、NP、M1、M2、NS1和NS2。
病毒表面的两种糖蛋白是HA和NA,HA比NA更丰富(每个病毒粒子约500个分子),比例为4:1至5:1。
HA头部是发生抗体反应的主要目标,其序列和糖基化位点变化多样。尽管HA的结构总体上是保守的,但其序列和糖基化模式在不同亚型之间不同。由于其高序列可变性,针对免疫优势头部的抗体反应是菌株特异性的,并且仅提供短期免疫。其头部含有RBS,它通过与唾液酸受体结合将病毒附着到宿主细胞上。RBS形成一个浅口袋,由4个部分组成:190螺旋和130、150和220环,除了220环外,RBS本身相对保守,而其余的头部在序列上是高度多样化的。
抗体通常针对5个主要抗原位点,即H1的Ca1、Ca2、Cb、Sa和Sb,以及H3的位点A-E,它们位于RBS周围。RBS位点的抗体可以阻断病毒附着或阻止受体介导的内吞作用,因此中和病毒。HA茎部主要在亚型内高度保守,并且在某种程度上跨亚型,以比头部结构域慢得多的速度进化(图4d)。
MEDI8852是一种人IgG1 mAb,从一名无并发症的甲型流感感染患者中分离出来,目前处于IIa期。Vir Biotechnology正在开发VIR-2482,这是一种中和甲型流感的mAb,它与HA的保守区域结合并能中和自1918年西班牙流感(H1N1)以来的所有主要毒株。因此,这种类型的抗体可用作通用预防剂,克服当前流感疫苗的局限性。此外,由于VIR-2482已通过改造其Fc区域延长血清半衰期。

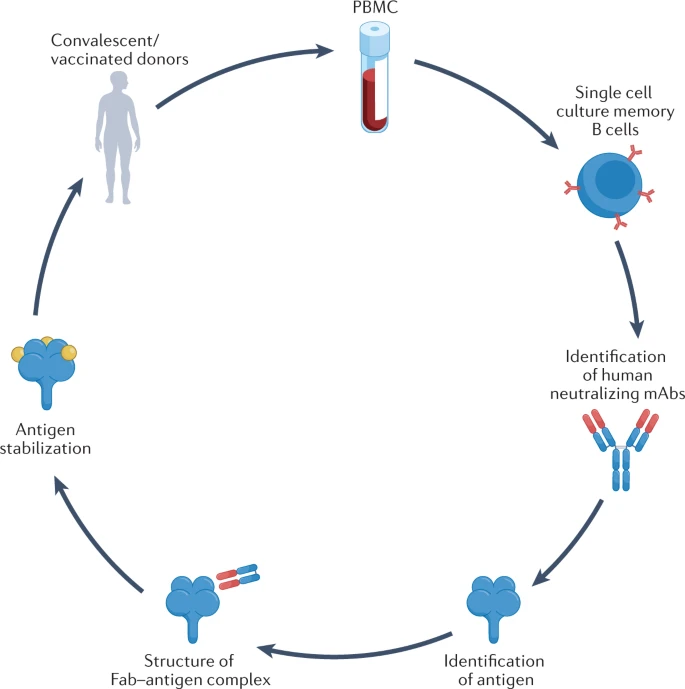
图5:反向疫苗学2.0
多个平台的疫苗已显示出对EVD的保护作用,其中两种并非基于反向疫苗学概念的疫苗已获得许可:包括Ervebo(rVSV-ZEBOV)和Zabdeno / Mvabea的联合使用。这两种疫苗都基于病毒载体,最近对接种疫苗的人类B细胞反应的分析表明,疫苗诱导的mAb中的体细胞超突变水平较低。基于蛋白质的亚单位疫苗的合理设计工作正在进行中。
其他正在开发的疫苗包括cAd3-EBOZ,一种黑猩猩腺病毒(cAd3)的减毒型,编码EBOV-GP糖蛋白。最后,发现含有EBOV-GPMakona株的重组纳米颗粒疫苗可诱导有效的免疫反应。
开发流感疫苗的主要障碍之一,是病毒附着的高度变化的HA头部的免疫优势。因此,基于结构的设计方法一直专注于HA茎区(图4d)。
为了将抗体反应转移到HA茎结构域,对嵌合HA分子进行了改造,该分子由与不同HA头配对的共同HA干组成。小鼠的反复免疫表明可以产生HA干特异性抗体反应,从而产生异源和异源亚型免疫。在雪貂中,这些构建体显示出在流感病毒攻击后减少病毒载量。嵌合HA已在I期临床试验中进行测试,证明其安全性,以及能够诱导广泛、强烈、持久和功能性的免疫反应。
也有设计策略通过去除HA头产生分离的HA干抗原,如Yassine等人的无头HA和Impagliazzo等人的mini-HA设计。

免责声明



 个人中心
个人中心
 我是园区
我是园区




