
黑素皮质素是由促肾上腺皮质激素(ACTH)和三种黑色素细胞刺激素(α-MSH、β-MSH和γ-MSH)组成的一类内源性多肽激素,它们通过作用于黑素皮质素受体(MC1R-MC5R)参与机体应激反应、能量平衡、免疫调节和色素沉着等生理活动。黑素皮质素的分泌受到胃饥饿素、瘦素和胰岛素等激素的调控。
鉴于黑素皮质素系统在体内的重要作用,目前已有多种黑素皮质素多肽类似物被开发作为治疗皮肤病、肥胖症、厌食和2型糖尿病等疾病的潜在药物。比如,α-MSH类似物阿法诺肽(Afamelanotide)和赛美拉肽(Setmelanotide)分别获批用于治疗红细胞生成性原卟啉病和管理基因缺陷导致的肥胖人群的超常体重。
然而,由于缺乏对黑素皮质素与其受体复合物结构的认识,黑素皮质素与五种黑素皮质素受体之间相互作用的具体机制尚不清楚。比如环形多肽配体SHU9119不仅是MC1R和MC5R的部分激动剂,也是MC3R和MC4R的拮抗剂。黑素皮质激素系统的结构信息将助力我们对该家族配体差异活性分子基础的理解。

在本研究中,研究人员解析了MC1R在不同配体刺激下(α-MSH、Afamelanotide和SHU9119)分别偶联Gs蛋白复合物的冷冻电镜结构,分辨率分别达到3.0 Å、2.7 Å和3.1 Å。结合结构分析与功能实验发现,MC1R在跨膜区胞外侧形成一个较大的开口,以容纳“U”形的多肽配体和钙离子,黑素皮质素高度保守的HFRW基序插入到跨膜区的中央并提供了与受体的主要相互作用(图1a-d)。对HFRW基序的修饰改变了配体与受体之间相互作用的强弱,是配体差异活性的决定性因素。MC1R中的甲硫氨酸M128是将SHU9119从拮抗剂转变为部分激动剂的关键氨基酸。同时,位于配体正性结合口袋中的钙离子在该受体家族中高度保守,并介导配体与受体的结合。
此外,在AfamelanotideMC1RGs复合物的三维重构中,研究人员分出一类没有Nb35抗体密度的复合物构象(图1e)。将该结构与结合Nb35的结构比较发现,Gs在没有Nb35的情况下具有相对宽松的构象,αN螺旋上移,Gβ距MC1R更近并与受体的Helix 8形成相互作用;将后者截短或者突变其与Gβ相互作用的氨基酸后大大减弱了受体偶联G蛋白的能力,表明Helix 8与Gβ之间的相互作用在受体招募G蛋白中发挥重要作用。
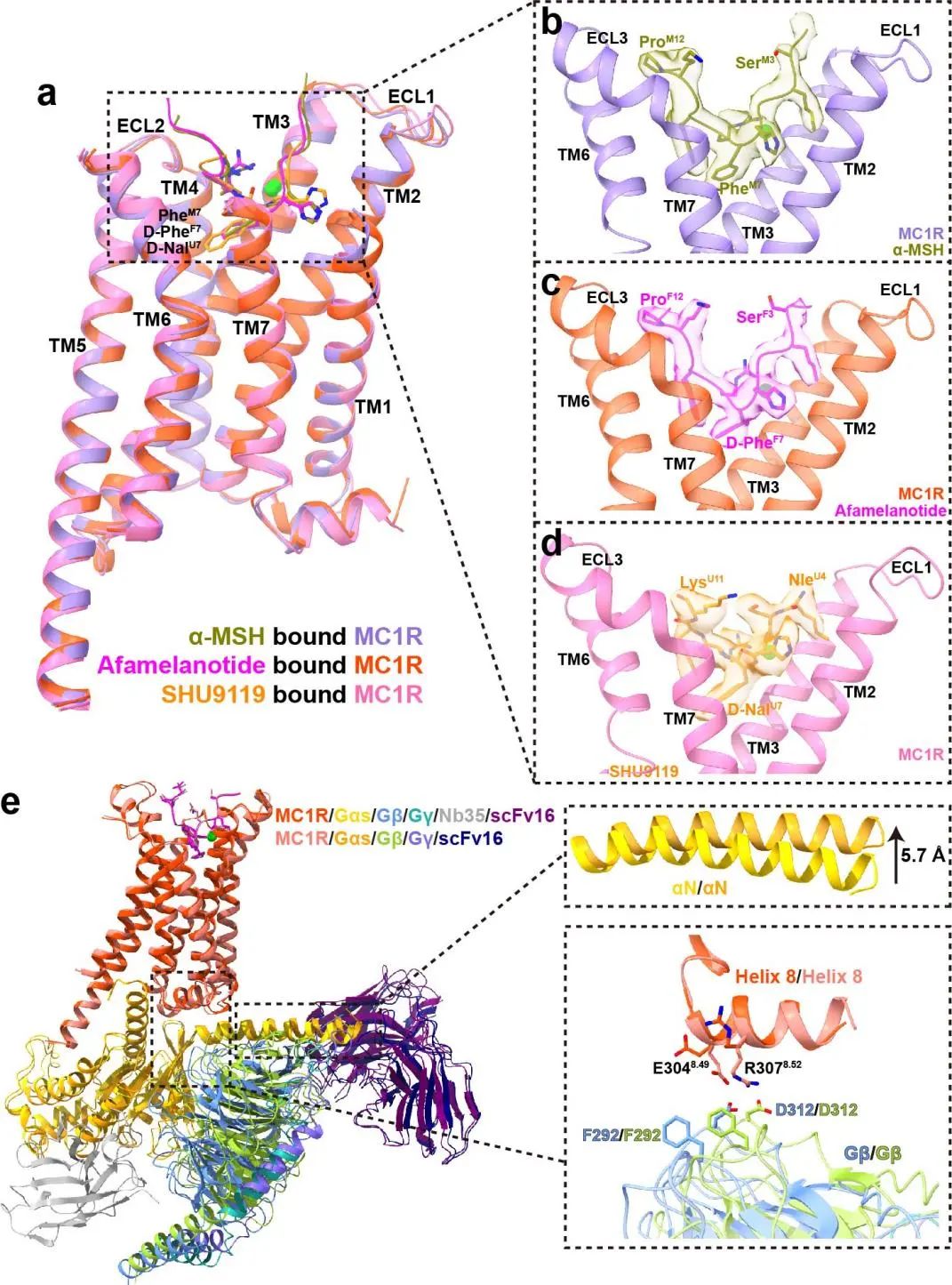 图1. MC1R识别α-MSH、Afamelanotide和SHU9119的分子机制。a-d MC1R的配体正性结合口袋;e AfamelanotideMC1RGsNb35scFv16与AfamelanotideMC1RGsscFv16复合物中受体与Gs蛋白作用界面的比较。
图1. MC1R识别α-MSH、Afamelanotide和SHU9119的分子机制。a-d MC1R的配体正性结合口袋;e AfamelanotideMC1RGsNb35scFv16与AfamelanotideMC1RGsscFv16复合物中受体与Gs蛋白作用界面的比较。
该研究为理解黑素皮质素系统配体识别的分子机制提供了结构模型,也为靶向黑素皮质素受体的药物设计提供了新思路。这项工作的冷冻电镜数据在中国科学院上海药物研究所冷冻电镜平台收集。上海药物所博士研究生马山山和复旦大学研究生陈彦为该论文的共同第一作者。徐华强研究员和王明伟研究员为共同通讯作者。该研究的第一完成单位是上海药物所。
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




