
点评 | 施蕴渝(中国科学院院士)
减数分裂后的雄性生殖细胞发育分化过程被称为精子形成
(spermiogenesis)
,期间单倍体精子细胞历经顶体和鞭毛形成、细胞核压缩、细胞质丢弃等过程,最终形成高度特化的精子
【1】
。在此过程中,随着细胞核压缩,基因组转录活动将逐渐降低直至完全停止,那些为后期精子细胞发育所需基因需提前转录为信使核糖核酸
(mRNA)
,然后以翻译抑制状态储存于信使核糖核蛋白
(mRNPs)
,至特定发育阶段被激活翻译蛋白质发挥功能,这个现象被称为“转录-翻译解偶联”,是精子细胞基因表达调控的典型特征
【2,3】
。然而,对精子细胞储存mRNA被如何翻译激活还有许多未解之谜。
中国科学院分子细胞科学卓越创新中心
(生物化学与细胞生物学研究所)
刘默芳
研究组长期致力于RNA调控在精子发生和男性不育中的功能机制研究,她们发现在早期精子细胞中,MIWI/piRNA通过招募翻译起始因子EIF3F和RNA结合蛋白HuR,激活了一组精子形成相关mRNA的翻译,揭示了一种调控精子细胞翻译的重要机制
【4】
。然而,在后期精子细胞中,MIWI/piRNA则结合脱腺苷酶CAF1,转而诱导了靶mRNA降解
【5】
。因此,目前还不清楚后期精子细胞中的翻译是如何激活的。
2022年8月12日,Science期刊以长文形式在线发表了刘默芳研究组与上海交通大学医学院附属新华医院黄旲研究组合作完成题为
LLPS of FXR1 drives spermiogenesis by activating translation of stored mRNAs
的研究论文,并配发了法国生物化学家Martine Simonelig教授团队撰写的题为
Translation, the bright side of phase separation
的评论【6】,该评论特别指出,
虽然在发育过程中RNP颗粒的动态变化已经被描述,但这些颗粒的形成如何发挥体内生物功能仍然是一个主要的挑战。这项研究是解决这一问题的一个重要进展。
在此研究中,作者为了探究后期精子细胞的翻译激活机制,首先通过比较不同发育阶段小鼠睾丸的多聚核糖体
(polysomes)
蛋白谱,挖掘后期精子细胞中潜在的翻译调控因子。通过此策略,作者发现RNA结合蛋白
FXR1
,一个脆性X综合征蛋白家族
(FXR)
成员,显著富集于包含后期精子细胞的成年睾丸组织来源多聚核糖体组份中。同时发现,在成年小鼠中,FXR1特异性地在睾丸中高表达,并在后期精子细胞中表达剧烈升高。随后,作者发现FXR1结合靶mRNA多在早期精子细胞中转录但仅在后期精子细胞中有效翻译。生殖细胞特异性敲除Fxr1不影响靶mRNA稳定性,但导致其在后期精子细胞中翻译活性降低、蛋白表达减少。Fxr1敲除小鼠无精、雄性不育。这表明FXR1对后期精子细胞的翻译和精子细胞发育均至关重要。
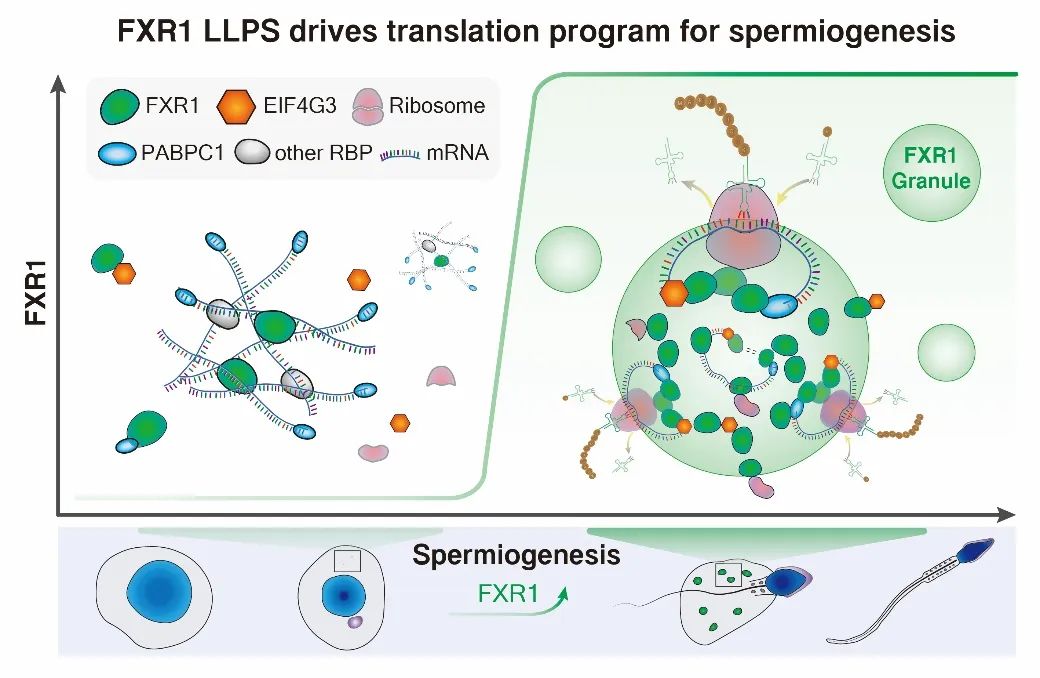
那么,FXR1如何激活靶mRNA翻译?在对精子细胞免疫染色时,作者发现随着FXR1蛋白水平升高,其在后期精子细胞中聚集为颗粒状,暗示FXR1具有蛋白浓度依赖的液-液相分离
(Liquid-liquid phase separation,
LLPS
)
性质。序列分析发现FXR1存在LLPS关联的内在无序区域
(IDR)
。随后,作者通过相分离、荧光漂白恢复、细胞内相融合等实验证明,FXR1蛋白具有典型的相分离能力。更进一步,作者对FXR1在小鼠睾丸中的蛋白质互作组进行了筛查,发现EIF4G3等多个翻译相关因子与FXR1存在相互作用,且在后期精子细胞中显著富集于FXR1颗粒中;与此同时,作者还发现FXR1颗粒中富集了大量靶mRNA。这些结果暗示FXR1在后期精子细胞中相分离可能与其对靶mRNA的翻译激活作用密切相关。
为确定FXR1相分离与其翻译激活作用的相关性,作者首先系统地筛查和鉴定影响FXR1相分离的区域和关键氨基酸,发现将351位的亮氨酸突变为脯氨酸
(L351P)
后,FXR1相变能力剧烈下降,但其RNA结合能力未受影响。随后,作者利用可表征胞内RNA翻译状态的TRICK报告系统
【7】
发现,野生型FXR1蛋白可在C2C12细胞的胞质中形成FXR1颗粒,且定位其中的靶mRNA显示为翻译状态;与之相反,FXR1 L351P变种蛋白不能形成颗粒,其结合靶mRNA散在分布于胞质并处于未翻译状态;在FXR1L351P末端连接FUS蛋白IDR区段重建相分离能力的FXR1L351P-IDRFUS融合蛋白可在胞质中形成颗粒,且有效激活定位其中靶mRNA的翻译。这些结果证明,FXR1相分离为其激活靶基因翻译必需。
作者进一步探索了FXR1相分离对精子细胞中靶mRNA翻译及精子形成的影响。利用拯救实验分析,作者发现野生型FXR1和FXR1L351P-IDRFUS融合蛋白,而非相分离缺陷FXR1L351P变种蛋白,可在Fxr1敲除的后期精子细胞中重建FXR1颗粒、有效恢复靶mRNA的翻译,并拯救Fxr1敲除小鼠的精子形成。最后,为了直接证明FXR1相分离是否为小鼠雄性生殖必需,作者利用CRISPR-Cas9结合半克隆技术构建了生殖细胞特异性敲入Fxr1L351P小鼠模型,发现Fxr1L351P突变小鼠与Fxr1敲除小鼠表型相同,也表现为靶mRNA翻译下降、精子形成受阻和雄性不育,直接证明FXR1相分离为后期精子细胞翻译激活和精子形成必需。
基于研究发现,作者提出了工作模型:在球形精子细胞中,低水平表达的FXR1协同其他RNA结合蛋白结合胞质mRNA转录本,组装成翻译抑制状态的mRNPs;在精子形成后期,随着表达水平升高,FXR1发生相分离形成FXR1颗粒富集靶mRNA,并与EIF4G3等翻译起始因子相互作用招募翻译机器,激活FXR1颗粒中存储mRNA的翻译,驱动大量后期精子形成所需蛋白的合成,以此保障精子细胞发育和精子生成
(图1)
。
近年来,由相分离形成的无膜细胞器被发现广泛存在于真核细胞中,可能通过富集蛋白质和/或核酸实现特定细胞过程的时空控制,其中最为典型的例子就是由RNA与RNA结合蛋白组成的核糖核蛋白
(RNP)
颗粒。尤其是,这类RNP颗粒普遍存在于生殖细胞中,
被称为生殖颗粒
(germ granules)
,是生殖细胞储存“休眠”mRNA的重要场所,但对生殖颗粒内mRNA如何被激活翻译还知之甚少。
此项研究证明FXR1 mRNP颗粒与翻译激活相关是一个新发现,尤其是大多数RNP颗粒都被认为是翻译抑制场所。
此外,
发现相分离对精子细胞发育和雄性生殖必需,证明相分离在体内具有重要生理功能,将在相分离领域产生广泛影响。
刘默芳研究组博士后康俊炎博士、温泽博士及博士研究生潘舵和钟艾、黄旲研究组博士后张玉涵博士、李劲松研究组博士后李庆博士与武汉大学周宇研究组博士研究生于兴海为本文的共同第一作者。
此项工作得到了美国加州大学付向东教授、中国科学院分子细胞科学卓越创新中心李劲松研究员、李党生研究员和苟兰涛研究员,武汉大学周宇教授,南京医科大学郭雪江教授,上海市计划生育科学研究所施惠娟研究员,美国贝勒医学院David L. Nelson教授等的大力支持和帮助。
http://doi.org/10.1126/science.abj6647
在哺乳动物中,精子形成 (减数分裂后雄性生殖细胞分化) 是一个高度协调的发育过程,由一组被称为生精基因共同调控。在雄性生殖细胞发育的早期阶段, 这些生精基因mRNA的翻译是被抑制的,它们与细胞核中的蛋白质形成惰性的核糖核蛋白颗粒,mRNP颗粒,这种mRNP颗粒被称为生殖颗粒(germ granules),起到储存mRNA的作用。直到精子发育的晚期,这些mRNA才被激活。秀丽线虫生殖细胞中的P granule是第一个被发现的无膜细胞器。目前人们已经知道细胞中的液-液相分离可以形成细胞中的凝聚物,也称为无膜膜细胞器。目前人们更多地研究关注在形成无膜细胞器的蛋白质与RNA的物理化学性质及其动力学,关注蛋白质的低复杂度的区域与RNA如何通过多价相互作用发生液-液相分离,但是对无膜膜细胞器形成的功能意义关注不够。目前已知在线虫中,核蛋白(mRNPs)在精子发育中有着重要作用,当mRNA退出P granule后mRNA才能被激活进行翻译。 但是人们全然不知道,在哺乳动物中这些被抑制的mRNA在精子发生晚期是如何被激活的。2022年8月12日上海生化细胞所刘默芳实验室在Science上发表题为LLPS of FXR1 drives spermiogenesis by activating translation of stored mRNAs的研究论文。该文首次揭示在小鼠精子发育晚期,RNA结合蛋白FXR1与mRNA相互作用,通过液-液相分离,形成mFXR1 granules募集翻译起始因子EIF4G3,poly(A) 结合蛋白 C1PABPC1及翻译机器,激活原先被抑制的mRNA,促进精子发育,产生成熟的精子。此项工作的重要意义在于在哺乳动物活体内揭示了相分离参与调控精子发育的机制,阐明了相分离过程重要的生物学意义。
制版人:十一
1. M. L. Meistrich, R. A. Hess, in Spermatogenesis: Methods and Protocols, D. T. Carrell, K. I. Aston, Eds. (Humana Press, Totowa, NJ, 2013), pp. 299-307.
2. P. Sassone-Corsi, Unique chromatin remodeling and transcriptional regulation in spermatogenesis. Science 296, 2176-2178 (2002).
3. R. K. Idler, W. Yan, Control of messenger RNA fate by RNA-binding proteins: an emphasis on mammalian spermatogenesis. J. Androl. 33, 309-337 (2012).
4. P. Dai, X. Wang, L.-T. Gou, Z.-T. Li, Z. Wen, Z.-G. Chen, M.-M. Hua, A. Zhong, L. Wang, H. Su, H. Wan, K. Qian, L. Liao, J. Li, B. Tian, D. Li, X.-D. Fu, H.-J. Shi, Y. Zhou, M.-F. Liu, A translation-activating function of MIWI/piRNA during mouse spermiogenesis. Cell 179, 1566-1581.e16 (2019).
5. L.T. Gou, P. D., J.H. Yang, Y. Xue, Y.P. Hu, Y. Zhou, J.Y. Kang, X. Wang, H. Li, M.M. Hua, S. Zhao, L.G. Wu, H.J. Shi, Y. Li, X.D. Fu, L.H. Qu, E.D. Wang, M.F. Liu. Pachytene piRNAs instruct massive mRNA elimination during late spermiogenesis. Cell Res 24, 680-700 (2014).
6. A. Ramat and M. Simonelig. Activating translation with phase separation. Science 377, 712-713 (2022).
7.J. M. Halstead, T. Lionnet, J. H. Wilbertz, F. Wippich, A. Ephrussi, R. H. Singer, J. A. Chao, An RNA biosensor for imaging the first round of translation from single cells to living animals. Science 347, 1367-1671 (2015).
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。








 个人中心
个人中心
 我是园区
我是园区




