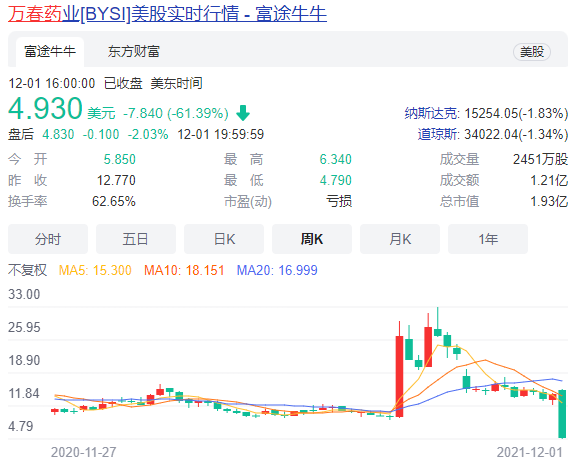
12 月 1 日,万春药业宣布收到 FDA 的完整回复函(CRL),认为普那布林的 3 期注册临床(106 研究)不足以支持其上市申请,需要补充额外的临床试验以证明临床获益。消息发布后,万春药业暴跌 60% 以上。
普那布林曾获得多项认可,FDA 和 NMPA 都授予其突破性疗法认定。在今年 5 月,万春医药在中美同步提交普那布林的新药上市申请(NDA),并被两国监管机构纳入优先审评审批。
CIN 适应症的上市申请基于 III 期试验 PROTECTIVE-2(即 106 研究;登记号:NCT03294577)的积极数据。在这项临床中,普那布林与培非格司亭联合治疗显著减少了化疗引起的重度中性粒细胞减少(CIN)的发生率,在主要和所有关键次要终点方面均都达到优效性。具体而言,在联合治疗组中,第一周期 4 级 CIN 的预防率超过 100%;联合治疗组中未发生 4 级 CIN 的患者百分比为 31.5%,而对照组这一数值为 13.6%,具有统计学显著差异(CI:17.90 [7.13,28.66],p=0.0015)。
除 CIN 适应症之外,普那布林还在积极开展联合用药临床试验以拓展适应症。今年 8 月 4 日随着普那布林在二/三线 NSCLC 适应症注册性 3 期临床 DUBLIN-3(103 研究)中取得成功,万春药业又迎高光时刻。消息发布当日,万春医药大涨 176%,市值逼近 20 亿美元。万春同时宣布拟于 2021 下半年与 FDA 和 CDE 召开 pre-NDA 会议,以支持 2022 年上半年提交 NSCLC 适应症 NDA。
8 月 26 日,恒瑞医药发布重磅交易,以 13 亿元与万春达成合作,获得普那布林产品,以与自身产品线产品联用互补。
然而,在今年 9 月份的 ESMO 大会中万春药业公布了这项 NSCLC 3 期临床数据,股价却不升反跌 30%。外界质疑声音主要集中在其试验设计的合理性方面,万春医药的普那布林 3 期临床开始时 PD-1/L1 单抗在相应地区尚未上市或尚未成为标准疗法,因此三期临床中经 PD-1/PD-L1 治疗比例不高(20% 左右);同时其美国入组人数比例偏低,导致市场对于普那布林能否获得 FDA 批准仍持观望态度。随后,万春股价一路下行,至今日暴跌 60%,又跌回了 8 月暴涨之前的市值。
今日万春在美国审评失利后,恒瑞医药迅速发布了公告做澄清说明。公告中表示,恒瑞已向万春支付 2 亿元的首付款,但尚未参与到临床开发当中;而此前达成的 1 亿元股权投资也尚未完成缴款和股权交割。截至发稿时,恒瑞医药小跌 2%。

普那布林在中国的首个上市申请如今仍处于新报任务审评中(查看审评进展)。能否通过审评顺利上市?在美国的 CIN 适应症补充临床试验和 NSCLC 适应症 pre-NDA 又将如何进展?Insight 将持续关注。
编辑:加一
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
点击卡片进入 Insight 小程序
药品申报、临床、上市、一致性评价…
随时随地查!
↓↓ 点击解锁更多新功能



 个人中心
个人中心
 我是园区
我是园区




