▎药明康德内容团队编辑
今日业界传来一则好消息,赛诺菲(Sanofi)与Sobi共同开发的重组蛋白药物Altuviiio(efanesoctocog alfa)获FDA批准上市,用以预防与治疗血友病A成人与孩童患者出血。FDA曾授予此疗法突破性疗法认定以及优先审评资格。

血友病是一种X连锁的单基因隐性遗传病。它的特征是血液凝结级联反应受到破坏,导致失控的出血事件。血友病A患者的凝血因子VIII(FVIII)突变或缺失,每5000位出生的男性中就有1位患有此疾病,而血友病B患者则是凝血因子IX(FIX)缺失。关节内和肌肉内出血是最常见的临床症状,但有时可能有危及生命的出血。重复关节出血会导致永久性关节损伤,关节疼痛和活动幅度受限,严重影响患者生活质量。目前常见的血友病治疗方法是定期输注凝血因子。
然而,在血友病A的治疗中,虽然输入的凝血因子VIII在血液中可与血管性血友病因子(von Willebrand factor,vWF)结合形成复合体,进而提高其在血液中的稳定性,但当vWF被降解时,与之结合的凝血因子VIII也同时被降解,因此凝血因子VIII在血液中的半衰期便受vWF蛋白所限制,只有12个小时左右,通常患者需要每周接受3-4次凝血因子VIII输注,这为他们的生活带来极大的不便。
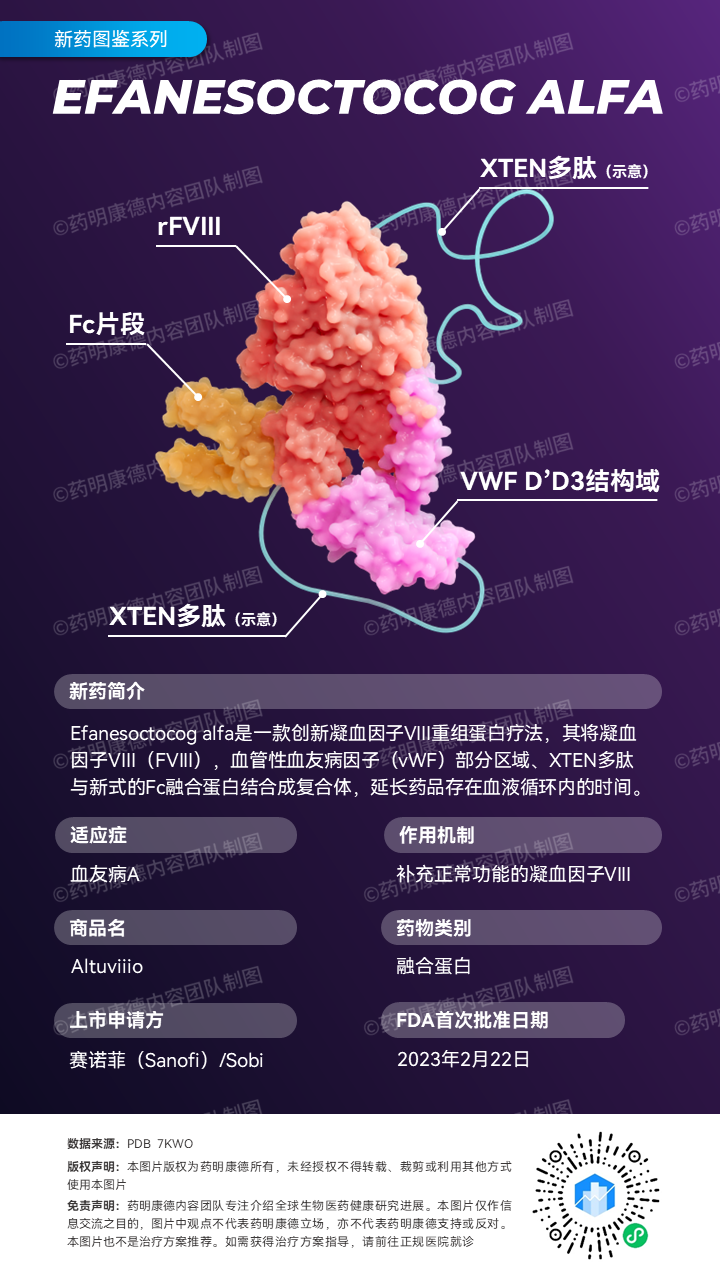
Altuviiio是一款长效的凝血因子VIII重组蛋白疗法,是设计用于以一周一次的频率对血友病A患者进行预防性治疗的药品。此药品将凝血因子VIII,vWF部分区域、XTEN多肽与新式的Fc融合蛋白结合成复合体,这将延长药品存在血液循环内的时间。这可能是首个突破vWF因子天花板的在研凝血因子VIII疗法。Altuviiio曾获FDA的突破性疗法认定、快速通道资格与孤儿药资格。欧盟委员会亦授予其孤儿药资格。
所递交的上市申请是根据XTEND-1试验结果。XTEND-1是一项开放标签、非随机的介入试验,目的为检视在那些曾经接受过凝血因子VIII疗法、12岁或以上的严重血友病A患者中(n=159),以一周一次剂量的Altuviiio治疗时的疗效与安全性。试验结果显示,每周一次Altuviiio预防性治疗,显著降低严重血友病A患者中的年出血率。与此前接受的凝血因子VIII预防性治疗相比,Altuviiio在预防出血方面亦表现出优效性。此外,此药物也展现良好的耐受性,没有在患者体内观察到凝血因子VIII抑制剂的产生。最常见的治疗伴发不良反应(出现在>5%总病患中)包含头痛、关节疼痛(arthralgia)、跌倒与背痛。XTEND-1试验详细结果发表于今年1月的《新英格兰医学杂志》。

近期血友病患者的福音频传。去年8月,欧盟委员会(EC)批准BioMarin Pharmaceutical用于治疗血友病A的基因疗法Roctavian(valoctocogene roxaparvovec)有条件上市,这是全球首款治疗血友病A的获批基因疗法。此疗法的上市申请在去年10月为FDA所接受,并预计在今年3月31日之前做出审评决定。此外,由CSL Behring与uniQure公司联合开发的Hemgenix(etranacogene dezaparvovec)在去年11月获FDA批准上市,这是FDA批准的首款治疗血友病B成人患者的基因疗法。Hemgenix在本周获欧盟委员会有条件上市许可,用于治疗没有使用过凝血因子IX抑制剂的重度和中度血友病B成人患者。同时,罗氏与旗下Spark Therapeutics公司联合开发的血友病A基因疗法SPK-8011在去年底所举办的美国血液学会(ASH)年会中亦展现积极的临床1/2期试验结果,患者的年出血率降低92%。检验这一疗法的3期临床试验预计在今年第一季度获得结果。
随着这些令人鼓舞的试验与监管结果出炉,让我们期待血友病患者能够更多地自这些新获批疗法中获益,生命与生活质量皆获得显著的改善。
了解更多FDA获批新药
请点击下图访问我们的小程序

大家都在看




▲欲了解更多前沿技术在生物医药产业中的应用,请长按扫描上方二维码,即可访问“药明直播间”,观看相关话题的直播讨论与精彩回放
[2] Konkle et al., (2020). BIVV001 Fusion Protein as Factor VIII Replacement Therapy for Hemophilia A. NEJM, DOI: 10.1056/NEJMoa2002699


分享,点赞,在看,聚焦全球生物医药健康创新



 个人中心
个人中心
 我是园区
我是园区






