 或许谁也无法预测新冠疫情何时是尽头,但可以肯定,战胜疫情让世界重新打开离不开有效的治疗药物上市。12月8日,随着两款中和抗体分别在中美两地获批,胜利的天平又朝着战胜新冠疫情倾斜了几分。我们看到,从官媒到自媒体,无不一片欢呼。
或许谁也无法预测新冠疫情何时是尽头,但可以肯定,战胜疫情让世界重新打开离不开有效的治疗药物上市。12月8日,随着两款中和抗体分别在中美两地获批,胜利的天平又朝着战胜新冠疫情倾斜了几分。我们看到,从官媒到自媒体,无不一片欢呼。
根据NMPA的公告,腾盛博药旗下腾盛华创提交的安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198)注册申请,获得应急批准。换言之,我国继新冠疫苗后,在西药治疗药物领域实现了“零”的突破。

此次获批基于一项NIH支持的ACTIV-2的III期临床,包括847例入组患者的积极中期及最终结果。最终结果显示,BRII-196 / BRII-198能够降低高风险新冠门诊患者住院和死亡风险80%(中期结果为78%)。并且,无论早期(症状出现后5天内)抑或晚期(症状出现后6至10天内)接受治疗,试验组的住院和死亡率降低均显著降低,这为新冠患者提供了更长的治疗窗口期。
对于深受新冠病毒突变困扰的世界来说,更长的治疗窗口期无疑代表着更大的利好。援引公开资料,仅有BRII-196 / BRII-198和VIR-7831(Vir Bio)在中和抗体后期临床中显示了广谱中和活性。
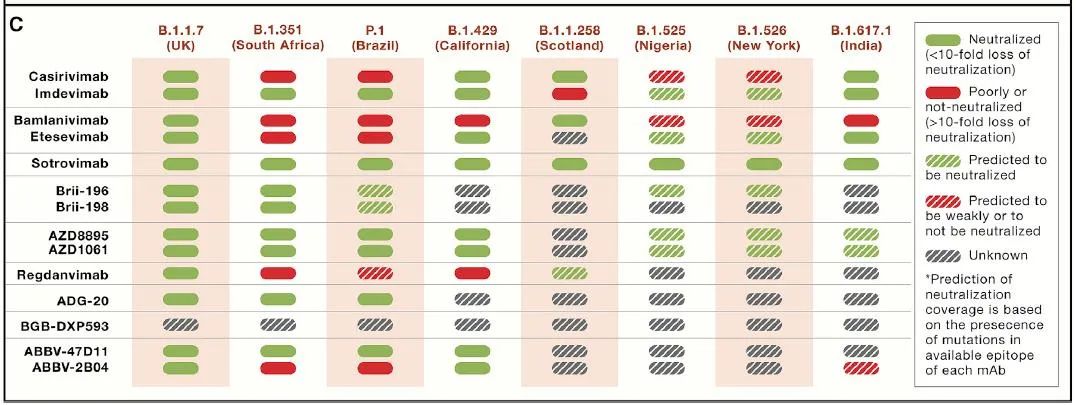
BRII-196 / BRII-198由清华大学医学院张林琦教授团队领衔,深圳市第三人民医院及腾盛博药参与研发。张林琦教授表示,该中和抗体组合“不仅可以抗病毒”,还能立竿见影地“提高免疫力”,效果“持续九个月、一年”。这也印证了中和抗体在治疗与预防上“二合一”的功效。
无独有偶,阿斯利康和范德堡大学医学中心联合开发的Evusheld(AZD7442),也因强大的疗效和长期保护作用受到关注。也是在12月8日,Evusheld获FDA紧急使用授权(EUA),用于特定成人和青少年(年龄≥12岁,体重≥40公斤)的新冠病毒感染暴露前预防。
Evusheld由tixagevimab、cilgavimab两种结合新冠病毒刺突蛋白不同表位的中和抗体构成。初步分析显示,Evusheld组受试者发生新冠的风险降低了77%,风险降低维持6个月。
FDA药物评估和研究中心主任Patrizia Cavazzoni认为,某些免疫受损的个体可能对新冠疫苗接种没有产生足够的免疫应答,或者对新冠疫苗有严重不良反应史。具备预防效果的中和抗体,提供了另一种可能。
据悉,腾盛博药在今年10月向FDA提交了BRII-196 / BRII-198的EUA申请,用于临床进展为重度疾病高风险的新冠门诊患者的治疗。
而本月初,FDA扩大了国内另一家Biotech公司君实生物和礼来共同开发的etesevimab / bamlanivimab的EUA,新增纳入特定高风险儿科人群(从出生至12岁以下)。也就是说,该中和抗体可为全年龄段的高风险人群提供治疗和预防新冠。
君实生物与礼来的合作源自去年5月,后者以最高2.55亿美元的价格获得etesevimab(JS016)海外权益,将其与bamlanivimab联合用于新冠治疗。多个III期临床显示,对轻到中度伴有转重症高危风险的新冠患者而言,etesevimab / bamlanivimab显著降低住院和全因死亡事件的发生风险(70%~84%),对死亡病例的保护达100%。
随后,etesevimab / bamlanivimab获得美国、欧盟、印度、巴西等15个国家和地区的EUA,是目前三个在国际上使用的新冠抗体疗法之一。
FDA首个新冠治疗中和抗体EUA来自再生元和罗氏。这款casirivimab / imdevimab药物组合,曾因被纳入美国前总统特朗普的治疗方案而被公众熟知。去年11月,FDA决定向casirivimab / imdevimab授予EUA,用于治疗病毒检测阳性、且进展为重度新冠(包括住院或死亡)风险较高的成人和青少年轻中度新冠患者。
GSK与Vir Bio共同开发的sotrovimab,5月份成为FDA授予EUA的第三款新冠治疗中和抗体,用于治疗12岁及以上患有轻度至中度新冠并有发展为严重疾病高风险的成人和儿童患者。
casirivimab / imdevimab和sotrovimab也受到日本的关注。目前,日本正在考虑批准sotrovimab在该国的使用,与此同时,扩大了原本针对轻症及中等症状新冠患者的casirivimab / imdevimab适用范围,用作对密切接触者等的发病预防药物。
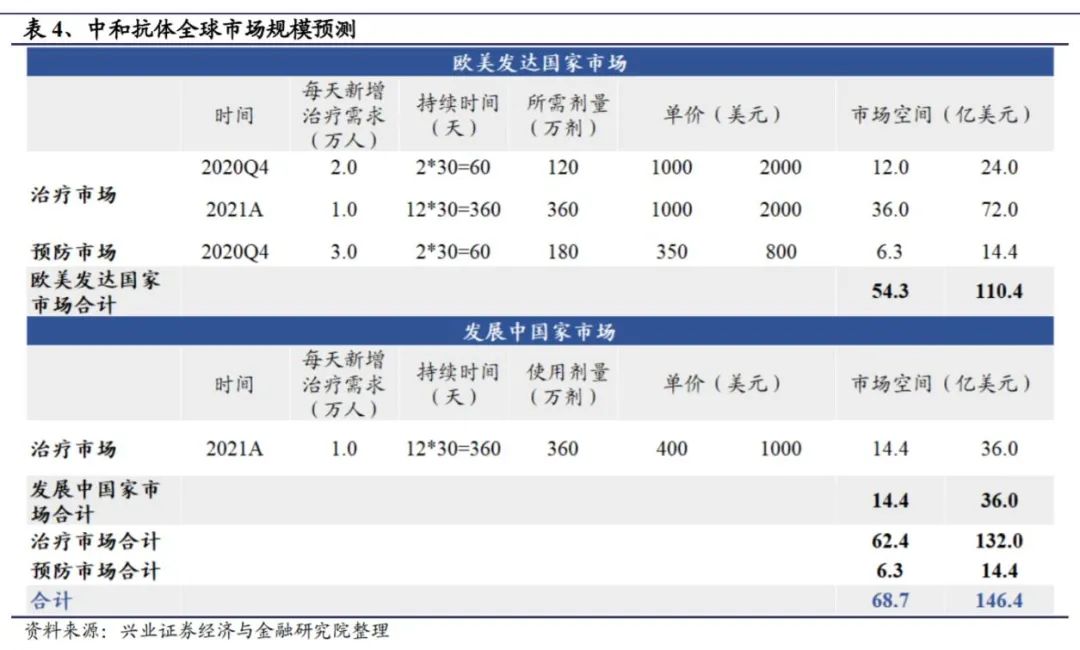
兴业证券预计,2021年末,全球中和抗体的市场空间可达68.7-146.4亿美元。其中,欧美发达国家市场空间更大,达到54.3-110.4亿美元;发展中国家市场规模约14.4-36.0亿美元。
另一方面,中和抗体用于患者治疗的市场空间更大,约62.4-132.0亿美元;用于高风险人群预防时,因为价格高、预防时间短等劣势,与疫苗形成直接竞争。后进者想要突围,或许可从实现长效免疫的角度尝试。
相较于机制新颖的中和抗体,基于本土的政策与产业环境,中药领域似乎呈现出“风景这边独好”的局面。
莲花清瘟胶囊/颗粒属于这场寻找新冠治疗药物的竞赛的“胜出者”之一。2020年4月,连花清瘟胶囊和连花清瘟颗粒获得NMPA批准在原批准适应症的基础上“功能主治”项增加“在新型冠状病毒性肺炎的常规治疗中,可用于轻型、普通型引起的发热、咳嗽、乏力。”“用法用量”一项增加“新型冠状病毒肺炎轻型、普通型疗程7-10天。”
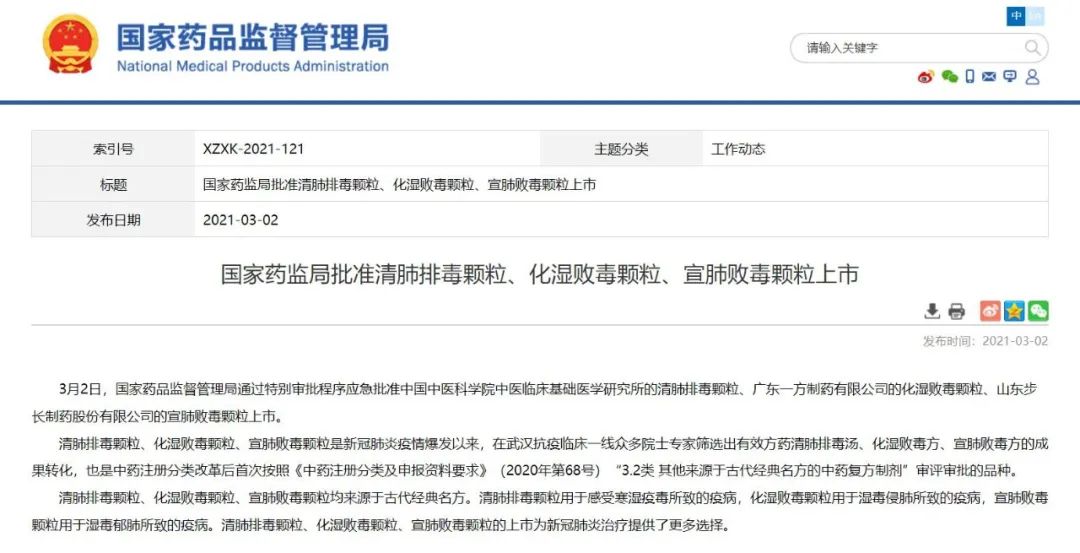
今年3月,NMPA通过特别审批程序应急批准中国中医科学院中医临床基础医学研究所的清肺排毒颗粒、广东一方制药有限公司的化湿败毒颗粒、山东步长制药股份有限公司的宣肺败毒颗粒上市。三者均来源于古代经典名方,为新冠治疗提供了新的中医药产品。
不过,要论影响力和知名度,不得不提及的是在这场全球大流行之初就成为“人民的希望”的瑞德西韦。
去年5月,FDA率先授予瑞德西韦EUA。同年10月,瑞德西韦拿到NDA的完全批准,成为迄今唯一正式被FDA批准用于治疗新冠的抗病毒药物,可在成人和体重在至少88磅的12岁及以上儿童中使用。凭借EUA和NDA,瑞德西韦在2020年为吉利德带来了28亿美元收入。
小分子抗病毒药物的又一次占据媒体焦点,从今年下半年开始。
7月中旬,开拓药业研发的新一代AR拮抗剂和降解剂普克鲁胺,在巴拉圭拿到首个EUA,用于巴拉圭国家公共卫生和社会福利部医院系统新冠住院患者的治疗。
10月1日,默沙东宣布莫努匹韦(Molnupiravir)III期临床中期研究进展:莫努匹韦可降低处于轻症或中症阶段的感染者(受试患者)的50%的住院风险或死亡风险。10天后,默沙东向FDA提交莫努匹韦的EUA,用于治疗有发展为重度风险和/或住院风险的轻度至中度新冠成年患者。
在美国之前,11月4日,英国先一步批准莫努匹韦的上市申请。第二天,辉瑞也公布其在研口服新冠候选药物Paxlovid最新研究结果,Paxlovid可以减少高达89%的新冠非住院患者的住院或死亡率。其中,治疗组住院或死亡率为仅为0.8%(389例中3例住院,无死亡),安慰剂组住院或死亡率则为7%(385例中27例住院,其中7例随后死亡)。
11月16日,辉瑞向FDA提交Paxlovid的EUA,并着手在英国、澳大利亚、新西兰和韩国等地递交滚动申请,获批在即。市场还猜测,辉瑞已与凯莱英达成4.81亿美元的合作,为Paxlovid的原料药供应进行准备。
此次腾盛博药BRII-196 / BRII-198的获批,标志着我国在新冠疫情防控与患者治疗上,取得又一重大突破。
从疫情之初“肺炎1号方”的广泛使用,到莲花清瘟胶囊/颗粒、清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒的获批,“中国经验”发挥着越发瞩目的作用。
目前,普鲁克胺在美国的新冠轻症临床III期试验已经完成半数以上患者入组,预计12月份会有III期临床中期数据发布。我们也期待普鲁克胺在国内获批,开启国内小分子治疗新冠药物的新局面。
可以预期,随着不同机制的新冠治疗药物陆续上市,人类在应对因病毒株突变而反复的疫情上,将逐渐掌握主动权。而中国将为世界贡献一个又一个“人民的希望”。
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。

 或许谁也无法预测新冠疫情何时是尽头,但可以肯定,战胜疫情让世界重新打开离不开有效的治疗药物上市。12月8日,随着两款中和抗体分别在中美两地获批,胜利的天平又朝着战胜新冠疫情倾斜了几分。我们看到,从官媒到自媒体,无不一片欢呼。
或许谁也无法预测新冠疫情何时是尽头,但可以肯定,战胜疫情让世界重新打开离不开有效的治疗药物上市。12月8日,随着两款中和抗体分别在中美两地获批,胜利的天平又朝着战胜新冠疫情倾斜了几分。我们看到,从官媒到自媒体,无不一片欢呼。









 个人中心
个人中心
 我是园区
我是园区




