注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及)。
一、2016.1.1-2021.4.30FDA批准的NDA
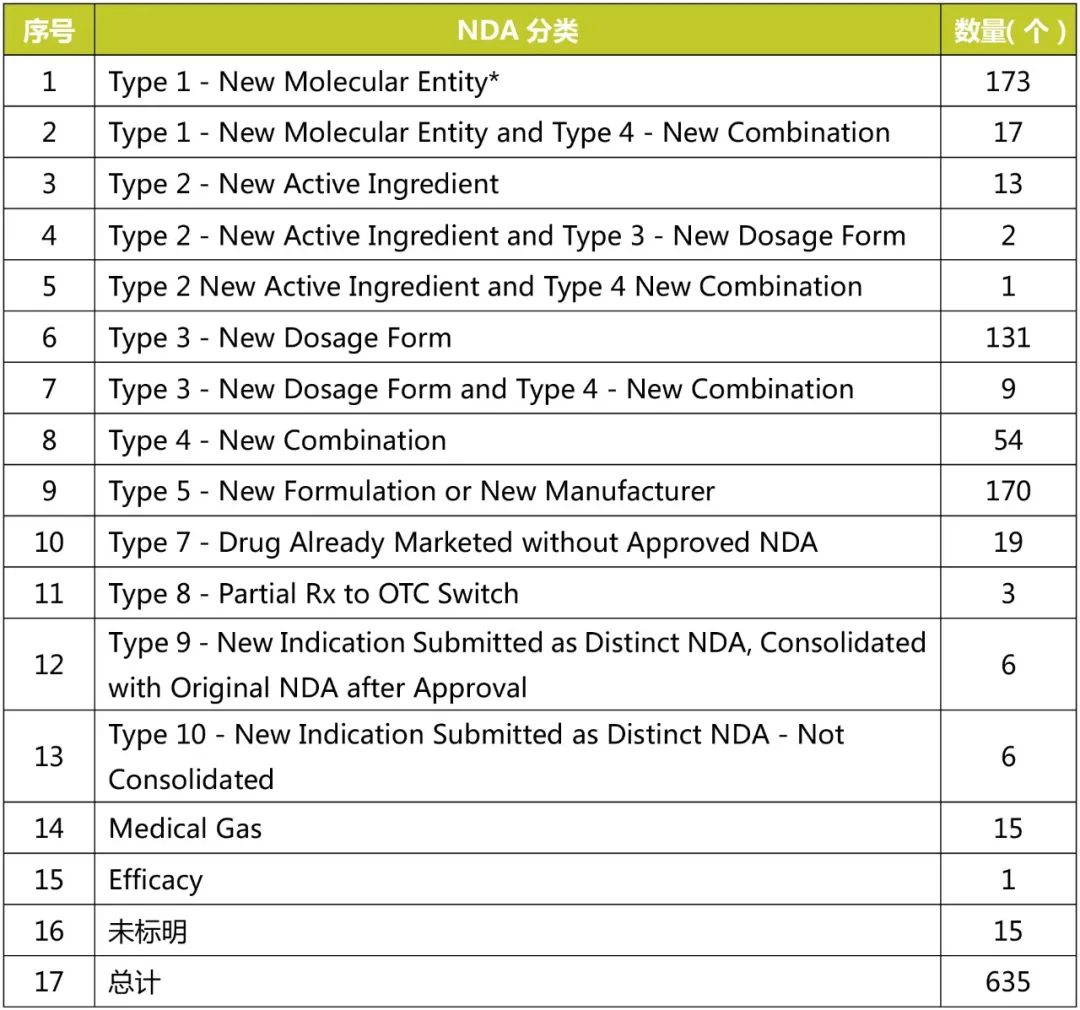
本文统计了2016年1月1日至2021年4月30日FDA批准的NDA,结果见下表。
表1 FDA批准的NDA数量统计(2016.1.1-2021.4.30)
注:*该类是单独Type1,不包括序号2中Type1 and Type4的数量。Type2、Type3统计方式同Type1一致。
由以上统计可知,Type3新剂型的NDA数量仅次于Type1和Type5,是505(b)(2)途径申报的主要类别之一,因此,分析该类别的批准情况,可以为改良型新药的新剂型开发提供参考和思路。
图12016年-2021年Type3新剂型NDA数量图
由上图可知,从2016年至2020年,每年批准数量相差不大。2021年只统计了1-4月,较往年同期偏少,可能和新冠疫情影响有关。总的来说,Type3NDA数量近几年保持稳定。
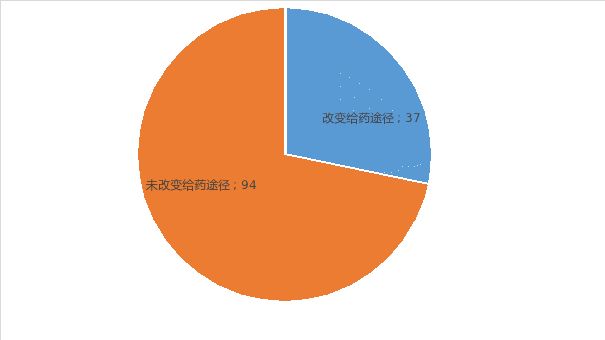
Type3新剂型共131个,其中改变给药途径品种37个,未改变给药途径品种94个。
图2Type3中改变给药途径和未改变给药途径NDA数量对比图
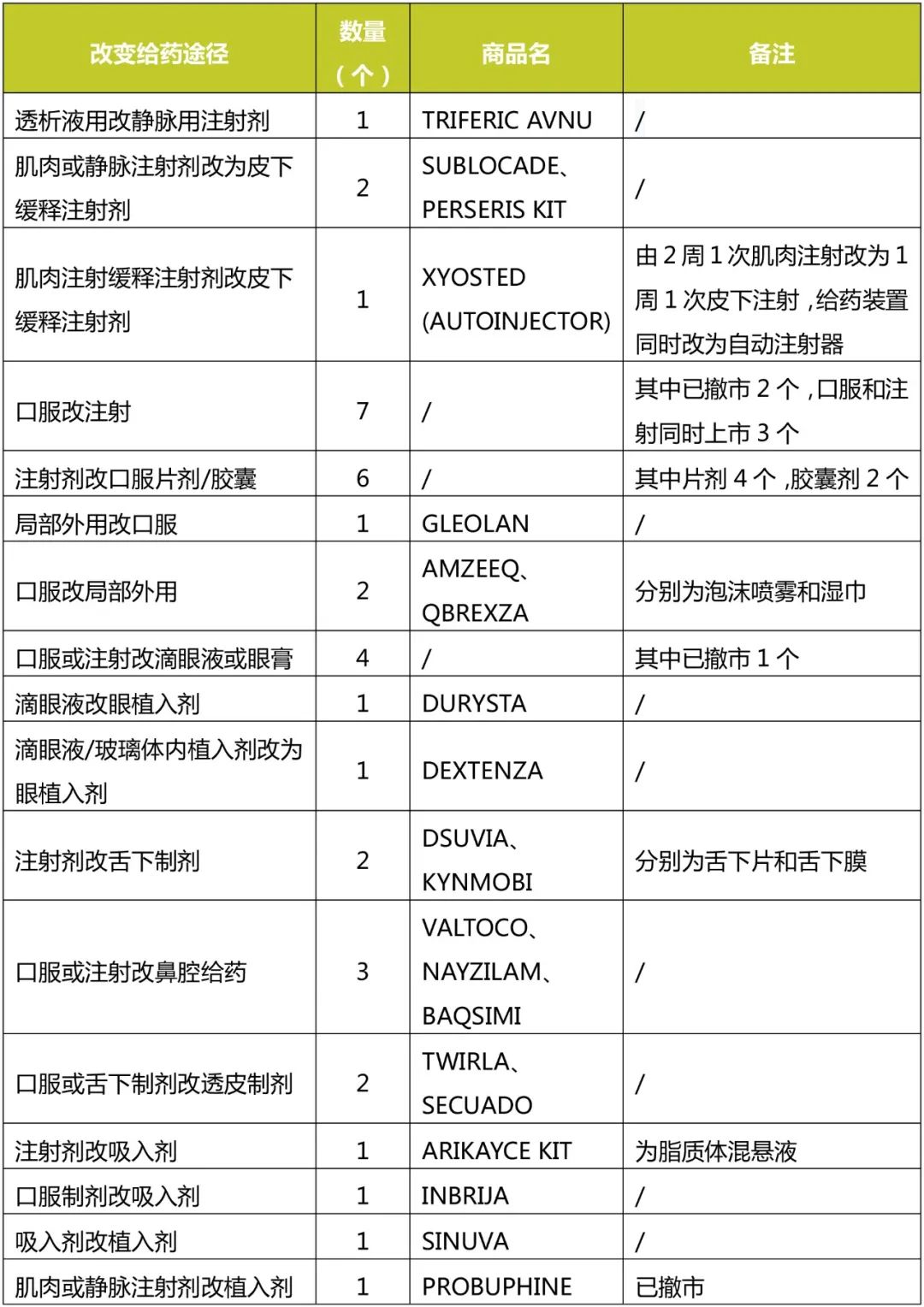
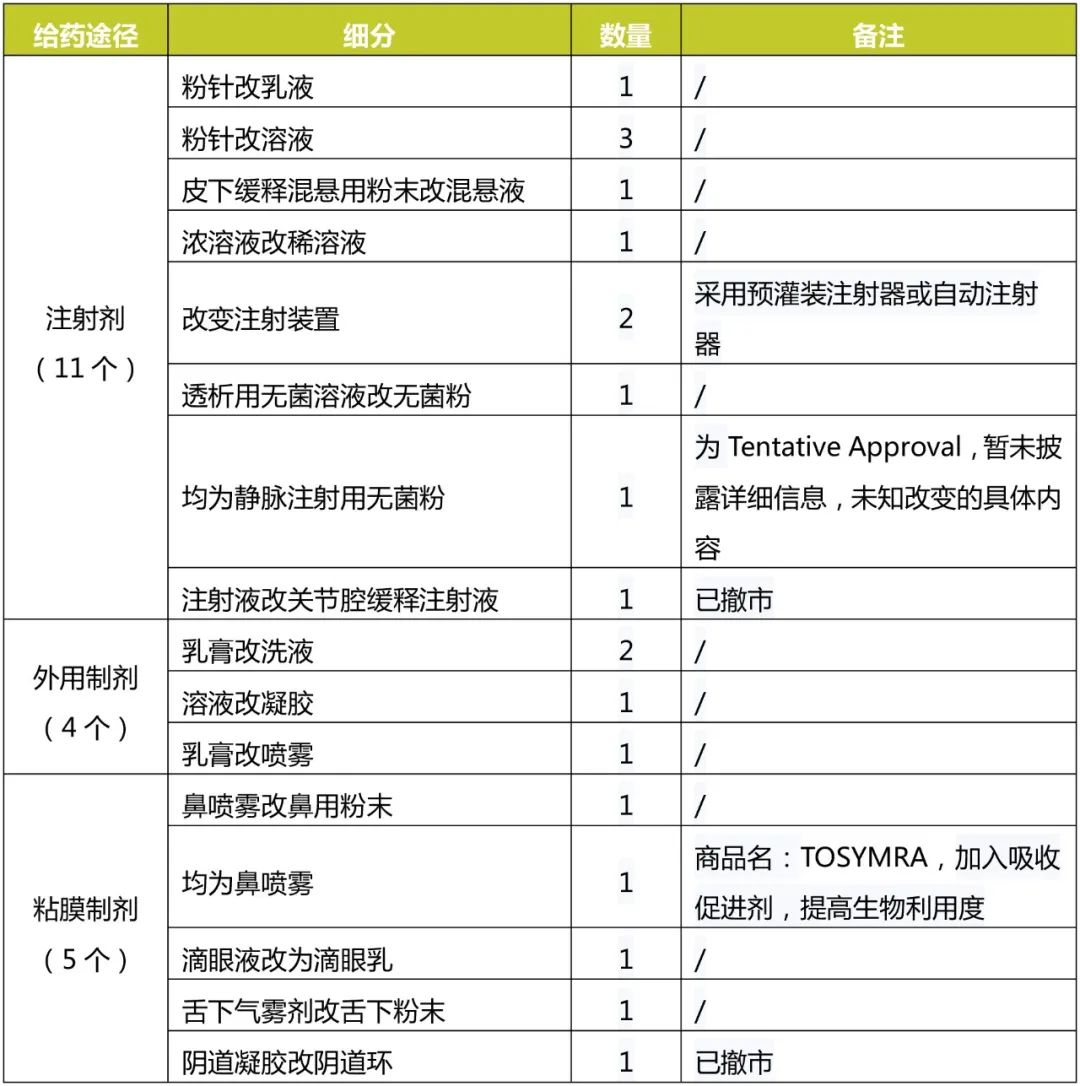
对改变给药途径的37个NDA进行统计,具体结果见下表。
口服制剂改注射剂数量最多,按Type3共批准了7个,但除去已撤市的和口服、注射同时上市的,严格意义上口服制剂改注射剂成功的只有美洛昔康和盐酸西替利嗪两个品种。
注射剂改口服制剂共批准6个,目前均在售,因此该类实际是改变给药途径成功上市数量最多的。
另外,口服或注射改粘膜给药制剂也较多,其中眼为局部用药,鼻腔、舌下可实现全身给药,且避过肝脏首过效应。如BAQSIMI经鼻给药可代替注射实现对低血糖患者的抢救。
虽然改变给药途径大多会同时改剂型,但其更主要在改变给药途径,改剂型只是为了适应给药途径的需要,故不属于我们常说的改剂型范畴,我们常提到的改剂型是不改变给药途径,单纯改变制剂的剂型,故对其进行重点讨论。
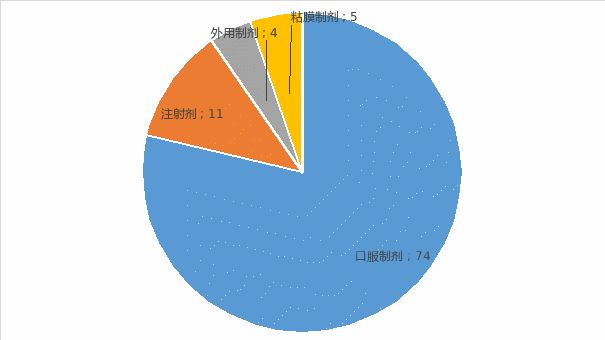
不改变给药途径改剂型(以下简称改剂型)FDA共批准94个,其中口服制剂共74个,占78.7%,注射剂11个,占11.7%,局部外用制剂4个,占4.2%,粘膜给药制剂5个,占5.3%。可见改剂型以口服制剂为主,其次为注射剂。
根据以上信息,注射剂改剂型主要为无菌粉改为溶液或混悬液,浓溶液改为稀溶液,减掉加液溶解或稀释的过程,方便使用,减少注射剂用前准备环节,降低产生污染或出现差错的可能。
粘膜给药制剂和外用制剂大多是为了方便使用,延长滞留时间来改剂型。TOSYMRA通过加入吸收促进剂,从而提高了生物利用度。
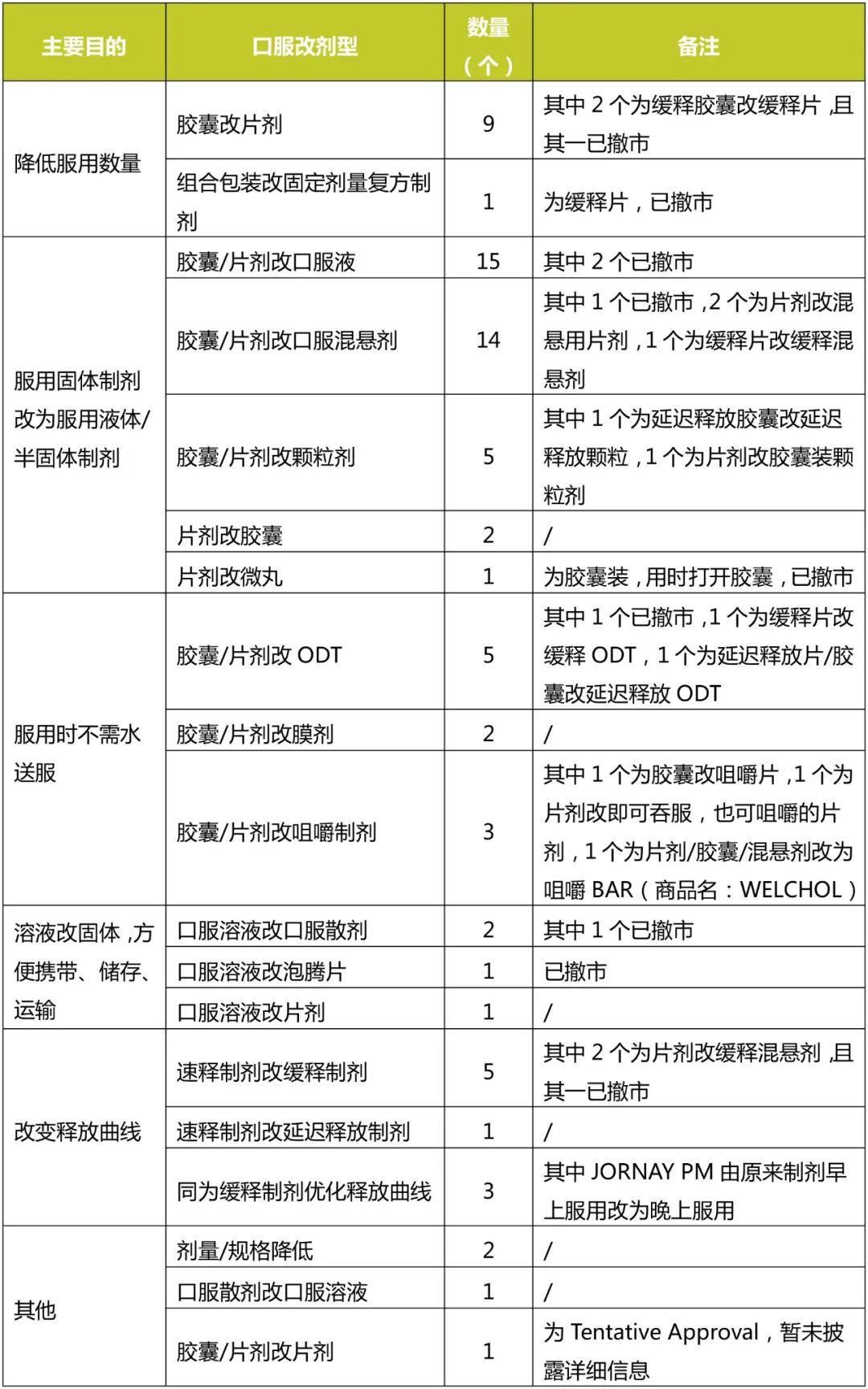
胶囊/片剂改口服液、胶囊/片剂改口服混悬剂、胶囊/片剂改颗粒剂这三者占了口服改剂型的46%,将服用固体制剂改为服用液体、半固体制剂,方便吞咽困难的患者服用,也方便分割剂量,进行个体化给药。胶囊/片剂改口服液适用于溶解度大,稳定性好的药物。口服混悬剂包括干混悬剂、混悬液、混悬用片剂,胶囊/片剂改口服混悬剂更适用于难溶性药物,稳定性差的药物。胶囊/片剂改颗粒剂适用于稳定性差的药物,药物溶解性高低均可。
片剂改胶囊剂:该改变上市的制剂较少,根据批准的两个NDA,改胶囊剂后除了正常吞服外,均增加了将内容物加到果酱或酸奶等服用的方法,方便了吞咽困难/儿科患者服用。因此,将该类归到服用半固体、液体制剂中。
胶囊改片剂:该类别上市品种也较多,改变的目的主要有以下几方面:(1)一次服用多粒胶囊改为服用1片片剂,这种改变是该类中最多的,占比一半以上;(2)胶囊太大,改为较小的片剂方便服用,如XTANDI;(3)胶囊有多个规格,通过片剂刻痕实现较少规格的片剂即可替代多个规格的胶囊,方便患者增减剂量,如SIKLOS,通过带3刻痕片剂,只用2个规格即代替了6个规格的胶囊;(4)改后服用量基本一致,只是针对不愿服用胶囊的患者,这种改变一般均为原研厂家申请,数量很少。
胶囊/片剂改ODT、膜剂、咀嚼制剂:服用时不需水送服,方便服用,适用吞咽困难的患者。其中ODT、膜剂适用小规格药物,咀嚼制剂适合大规格药物,其中咀嚼BAR适合超大剂量药物。
速释制剂改缓释制剂:共成功上市4个,主要是降低服药次数,提高患者用药顺应性,平滑血药浓度峰谷,降低不良反应。但速释制剂改缓释制剂对候选药物要求较高,比如吸收部位、半衰期、剂量等,故成功上市品种较少。
根据以上汇总分析,成功率较高的改剂型(不改变给药途径)可以从以下几方面进行考虑:
注射剂:减少用前准备步骤,可考虑粉针改溶液;普通西林瓶、安瓿包装改预灌装或自动注射器包装。
口服制剂:固体制剂如片剂、胶囊可考虑改口服液、混悬剂、颗粒剂,方便吞咽困难的患者服用或儿科患者服用,方便分割剂量;低剂量药物改ODT、膜剂,高剂量药物改咀嚼制剂,方便患者服用;但以上改变均要注意药物对口腔和食道的刺激性和口感,同时需关注药物在口腔的吸收情况。
以上改变,通常也并不容易,需要克服以下难点:液体制剂的稳定性问题;药物的掩味问题;液体制剂缓控释问题;缓控释单元、迟释单元粒径微小化,解决砂砾感问题;口服液、混悬液给药装置分剂量准确、使用方便、易携带等创新改进问题。
1.Drugs@FDA数据库https://www.accessdata.fda.gov/scripts/cder/daf/
2.NDA Classification Codes.FDA Officeof Pharmaceutical Quality,EffectiveDate: 11/04/2015. https://www.fda.gov/media/94381/download

各位朋友好,觉得本文对您有帮助,请随手点一下下方的在看,以便让你的朋友也能看到哦。


 药选址
药选址






