

近日(3月28日),日本企业Maruho研发的IL-31Rα抗体Nemolizumab在日本获批上市,治疗难治性特应性皮炎相关的瘙痒,商品名为Mitchga。

Nemolizumab是全球首个获批上市的IL-31Rα抗体,其治疗特应性皮炎相关瘙痒于2020年7月发表于新英格兰医学杂志NEJM,文章题为“Trial of Nemolizumab and Topical Agents for Atopic Dermatitis with Pruritus”,皮下注射给药60mg,4周给药一次,治疗16周后可显著改善患者的瘙痒症状、生活质量及失眠状况,详细结果参见“抗瘙痒抗体:新英格兰医学发表IL-31Rα抗体Nemolizumab三期临床结果”。

值得一提的是,Nemolizumab由日本中外制药最初研发,代号为CIM331。2016年9月,中外制药在完成湿疹中重度瘙痒的二期临床研究后选择将其权益转让,
将日本权益授权给日本企业Maruho,中外制药则保留开发血液透析患者瘙痒适应症的权益,日本和中国台湾地区之外的权益则授权给法国Galderma制药。
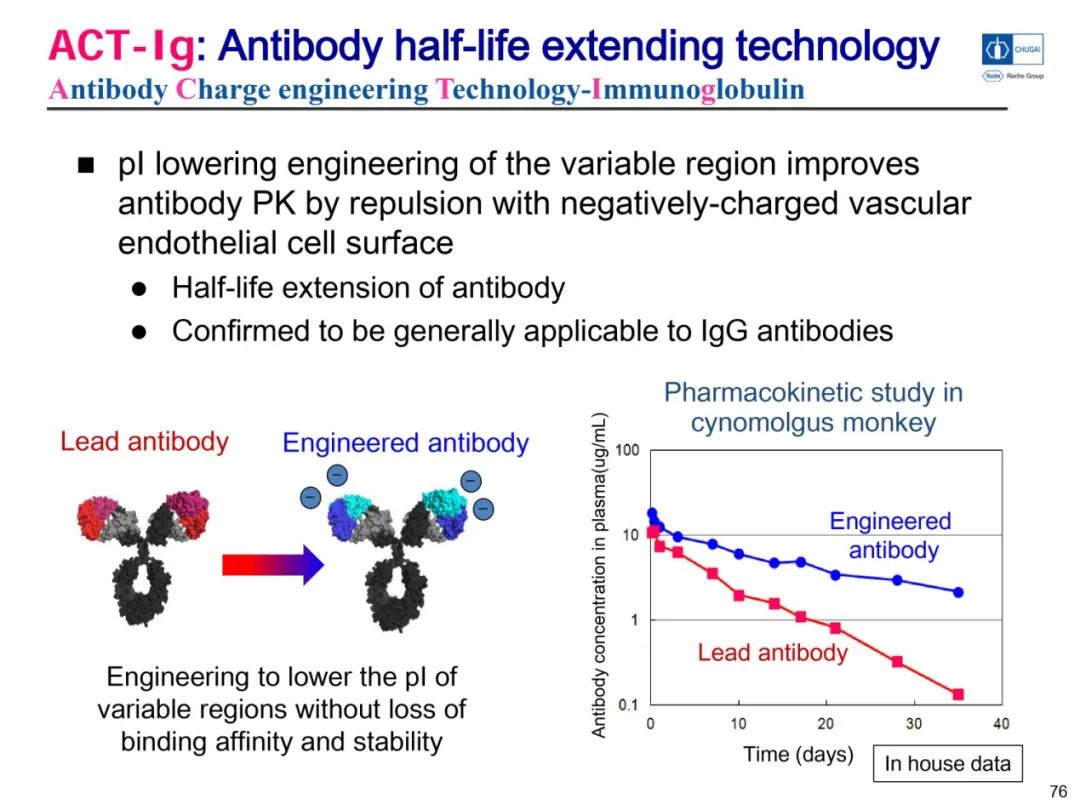
Nemolizumab采用了中外制药的ACT-Ig技术,旨在通过在可变区引入带负电的氨基酸降低可变区的pI,从而使抗体与带负电荷的血管内皮细胞表面相互排斥而延长抗体半衰期。Nemolizumab是Hemlibra和Enspryng之后直接采用中外制药技术上市的第三款抗体。
法国 Galderma制药目前正在开发Nemolizumab治疗特应性皮炎和结节性痒疹两个适应症,并均在2期临床取得成功。治疗特应性皮炎2期临床结果于2021年4月发表于欧洲皮肤病学和性病学会杂志JEADV,临床结果显示每4周皮下注射Nemolizumab可以48小时内改善患者的瘙痒症状和72小时内改善患者的睡眠质量,并且疗效可以持续到研究结束。
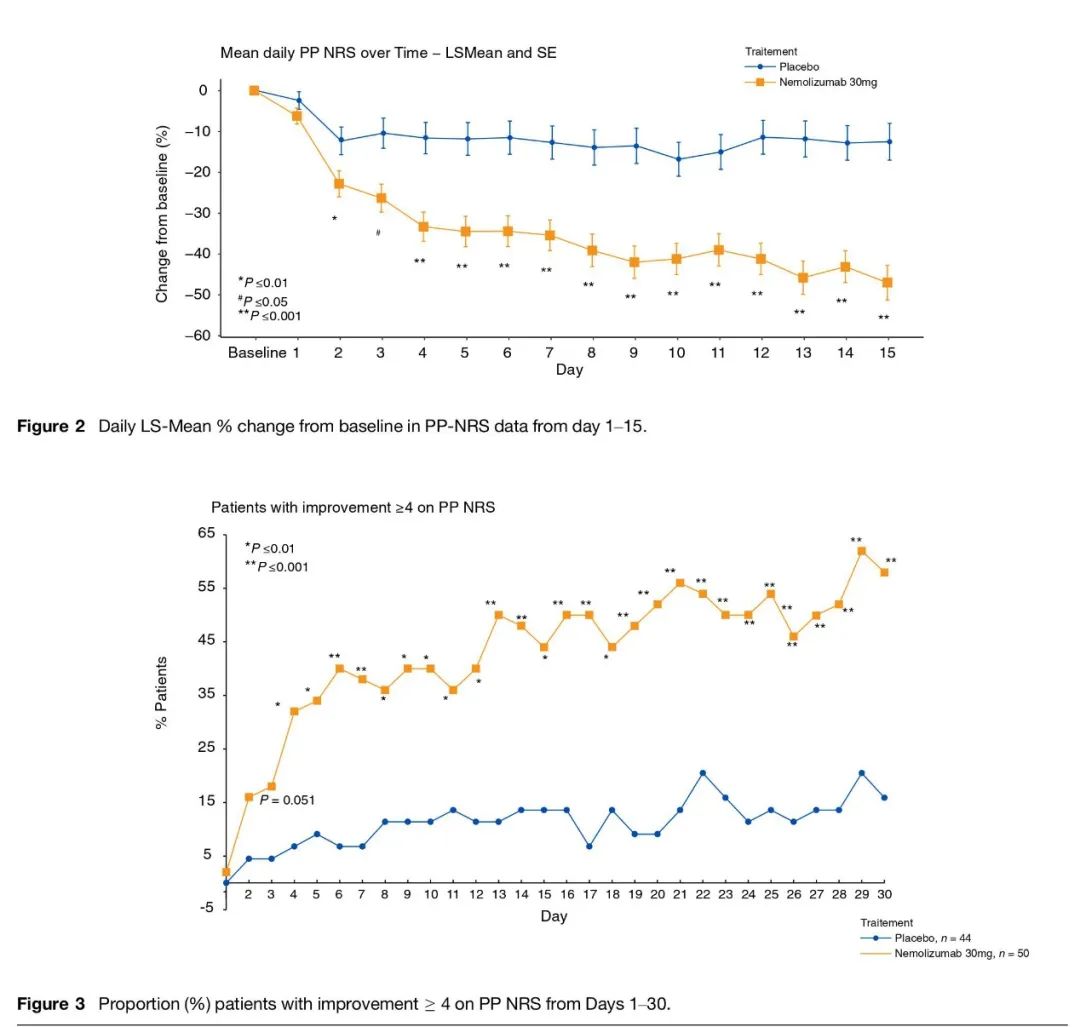
治疗结节性痒疹2期临床结果于2020年2月发表于新英格兰医学杂志NEJM,临床结果显示每4周皮下注射Nemolizumab可以快速改善患者的瘙痒症状。

小编总结
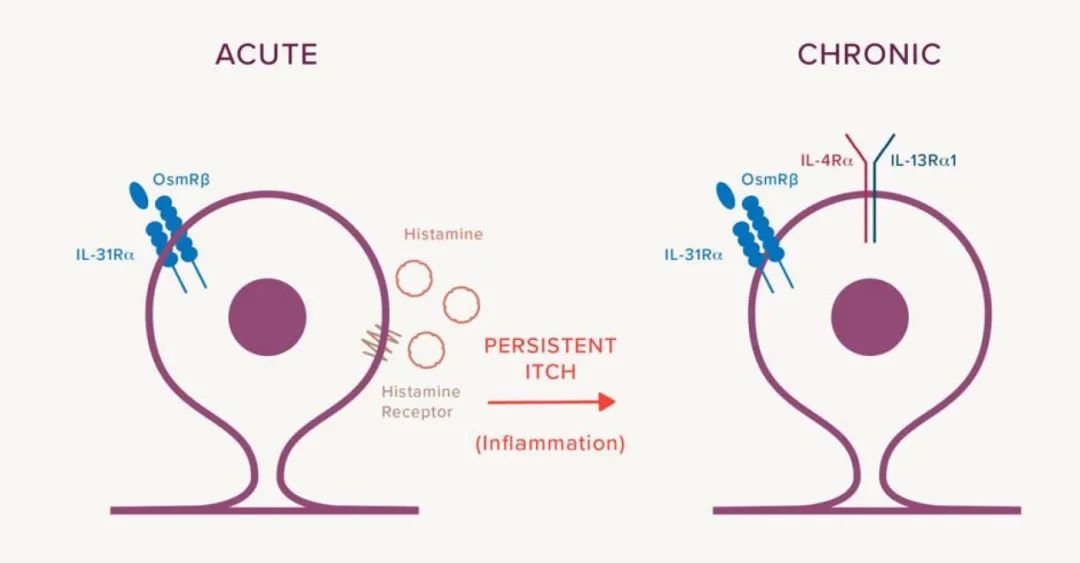
瘙痒是许多皮肤疾病,包括特应性皮炎和结节性痒疹最难受症状之一,可导致瘙痒-抓挠循环,进一步形成皮肤机械损伤、加剧炎症反应、加重瘙痒的恶性循环,严重影响患者的生活质量。

目前尚未完全理解的瘙痒的成因,但IL-4、IL-13和IL-31明确与瘙痒的发生发展有关,且IL-31与瘙痒感受神经元上的异源二聚体受体IL-31Rα结合后启动瘙痒,为直接参与瘙痒的细胞因子。
参考文献
1.Physiology and pathophysiology of itch
2.Trial of Nemolizumab and Topical Agents for Atopic Dermatitis with Pruritus
3.Nemolizumab is associated with a rapid improvement in atopic dermatitis signs and symptoms subpopulation (EASI ≥ 16) analysis of randomized phase 2B study




 个人中心
个人中心
 我是园区
我是园区




