
10月25日,勃林格殷格翰宣布向NMPA递交first in class单抗药物 Spesolimab的上市申请,用于治疗泛发性脓疱型银屑病(GPP)的发作。
泛发性脓疱型银屑病是一种较为少见的银屑病的亚型。其特征是反复发作泛发性的脓疱,常伴有高热,严重时可危及生命,治疗较为困难,目前缺乏统一的治疗方案。患者需要住院接受局部和系统药物治疗,包括控制炎症的免疫抑制剂、抗TNF药物以及预防感染的抗生素等,尚无快速缓解症状的靶向疗法可用。
在一些患有此病的患者中,已经发现IL36RN的功能缺失突变,IL36RN用于编码一种白细胞介素-36受体(IL-36R)拮抗剂。这一发现提示,IL-36R信号通路可能在银屑病的发病机制中发挥作用。
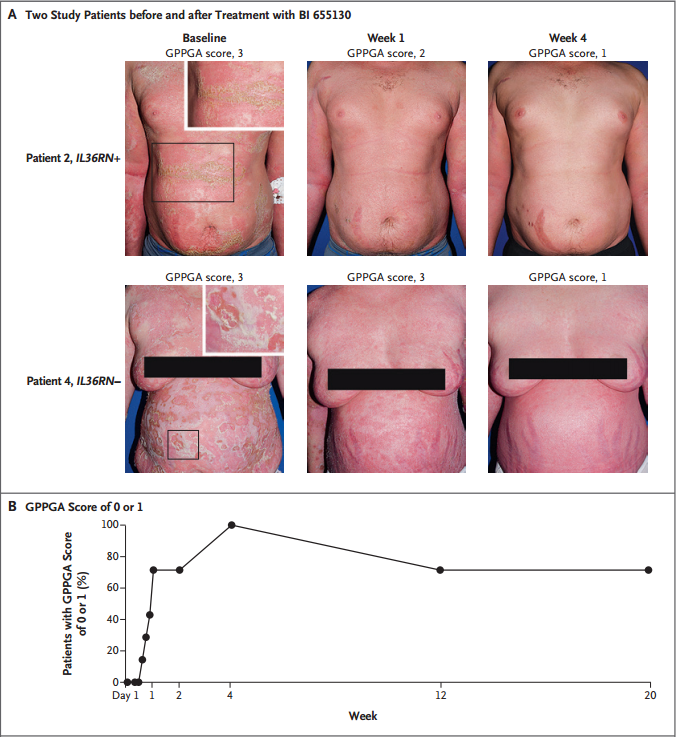
2019年3月,发表在新英格兰医学杂志上的一篇文献报道了BI655130(Spesolimab)治疗泛发性脓疱型银屑病患者的I期概念性验证临床研究结果。该项研究共纳入了7例全身性GPP患者,分别接受单剂、开放标签、BI 655130(10mg/kg)治疗,所有患者初始GPPGA(泛发性脓疱性银屑病医师总体评估)评分均值为3分(中度疾病,分越高病情越严重),脓疱亚评分2~4分。
研究结果显示,治疗1周,5例患者GPPGA评分变为0或1(清除或几乎完全清除),到第4周,所有患者(有或没有IL36RN突变)GPPGA评分均变为0或1。
Spesolimab属于IL-36R单抗,今年6月25日凭借治疗泛发性脓疱型银屑病 I期和II期临床试验中的优越表现获得CDE授予突破性治疗药物资格。勃林格殷格翰此次在中国提交上市申请是基于Spesolimab全球关键性II临床研究。结果显示:54.3%的患者经Spesolimab治疗1周便达到皮肤无可见脓疱;42.9%的患者经Spesolimab治疗1周可达到皮肤症状清除或几乎清除。同时在整个研究中,Spesolimab的安全性数据是可接受的,患者常见的不良事件包括发热和轻度至中度感染。
全球开发IL-36R项目的公司屈指可数,国内企业中目前仅有华博生物处于I期阶段。

温馨提示
医药魔方记录行业发展,揭示产业趋势,持续输出具有行业理解和深刻洞见的内容,包括药品市场格局变化、医药行业趋势演变、政策解读、代表性公司业务分析、医药行业标杆人物专访、重磅事件解读等,帮助用户理解医药行业生态和演变,辅助行业用户决策。
星标⭐医药魔方,这样就不会错过我们的推送啦~

操作步骤见上图:1)点击标题下方“医药魔方”,2)至右上角“…”,3)设为星标



 个人中心
个人中心
 我是园区
我是园区




