▎药明康德内容团队报道
12月6日,中国国家药监局药品审评中心(CDE)官网公示,天广实生物申报的注射用MBS303获得临床试验默示许可,拟开发适应症为CD20阳性的B细胞淋巴瘤。根据天广实生物早先新闻稿,MBS303是该公司自主研发的一款CD20/CD3 T细胞重定向双特异性抗体,本次获批的是一项治疗复发/难治性CD20阳性B细胞非霍奇金淋巴瘤(B-NHL)的1/2期临床试验。
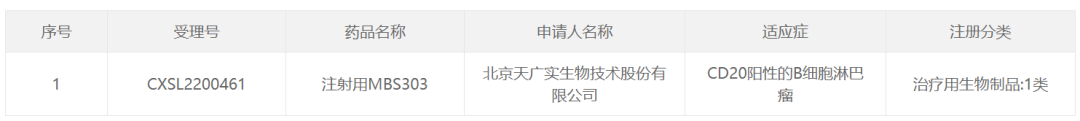 截图来源:CDE官网
截图来源:CDE官网
CD20是经临床验证的治疗靶点,在许多B细胞恶性肿瘤上表达,包括弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤和慢性淋巴细胞白血病等。
据天广实生物公开资料介绍,MBS303是一款2:1结构CD20/CD3双特异性抗体。通过两个结合臂与肿瘤细胞上的CD20结合,一个结合臂与T细胞上的CD3结合,MBS303增加了与肿瘤细胞的亲和力,诱导T细胞激活并减少脱靶毒性。同时天广实生物的设计使得MBS303的scFv稳定性得到增强,具有更好的成药性。此外,MBS303的特殊抗体结构设计可以在细胞比例较低的情况下,也能产生对肿瘤细胞较强的结合活性和杀伤活性,并对T细胞的亲和力以及激活相对可控。

临床前研究表明,MBS303具有较好的疗效及安全性。小鼠体内药效实验显示,MBS303在CD20阳性淋巴瘤小鼠模型中具有显著的抗肿瘤效应;体内外功能研究表明,MBS303诱导T细胞杀伤肿瘤过程中引起的细胞因子释放水平更低,有望降低细胞因子释放综合征(CRS)的发生风险,安全性更佳;在食蟹猴体内毒理学研究中未表现出显著的毒性。因此,MBS303具备差异化优势,其临床开发应用前景非常有潜力。
根据天广实生物早先新闻稿,本次MBS303获批的是一项开放、多中心、剂量递增和剂量扩展的1/2期临床研究,旨在评价MBS303治疗复发/难治性CD20阳性B-NHL的安全性、耐受性、PK/PD特征,并评估MBS303的初步疗效。
本文来由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。




 个人中心
个人中心
 我是园区
我是园区





