
据Insight 数据库 统计,上周(8 月 29 日 - 9 月 4 日)全球共有 49 款创新药(含改良新)研发进度推进到了新阶段,其中 15 款新申报临床,12 款首次启动临床。
下面,Insight 将分别摘取国内外部分重点项目做介绍。

国内创新药进展
国内方面,本周共有 45 款创新药研发进度推进到了新的阶段,其中,申报临床 20 款,获批临床 5 款,首次公示临床试验的有 13 款。另外,本周有多款新药/新适应症获批上市,是国内创新药「丰收」的一周。
上周国内首次启动临床的创新药(不含改良新)

来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
获批上市新药
1、万邦生化「甘精胰岛素」获批上市
9 月 2 日,NMPA 发布批件批准万邦生化的甘精胰岛素上市(受理号:CXSS2000009)。
甘精胰岛素注射液是一种新型的胰岛素类似物,具有长效、血药浓度无峰值、平稳地降低患者血糖的作用,由赛诺菲开发,分别于 2000 年 4 月和 6 月由美国食品药品管理局 (FDA) 和欧洲医药产品评审委员会批准用于糖尿病,商品名为来得时。2004 年来得时在中国上市。
据 Insight 数据库显示,此前国内甘精胰岛素共 6 款获批。除原研之外获批最早的是甘李的长秀霖,2005 年获批上市,而后联邦制药和通化东宝分别在 2016 和 2019 年获批。除已获批的 7 款之外,还有辽宁博鳌生物制药有限公司的甘精胰岛素正在上市申请中。
甘精胰岛素国内竞争格局

来自:Insight 数据库网页版
甘精胰岛素是去年胰岛素集采的品种之一,甘李药业、联邦制药、赛诺菲 A 组中标,通化东宝 B 组中标,东阳光药则以 C 组中标。其中排位第一的甘李报价 48.71 元/支,大降 63%,而第二位和第三位中标的联邦制药和赛诺菲也分别降价 49% 和 47.7%,报价 66.97 元/支和 69 元/支。
2、神州细胞工程 CD20 单抗获批上市
8 月 30 日,NMPA 发布批件批准神州细胞 CD20 单抗瑞帕妥单抗上市(受理号:CXSS1900047/8/9),用于国际预后指数(IPI)为 0~2 分的新诊断 CD20 阳性弥漫大 B 细胞性非霍奇金淋巴瘤(DLBCL)成人患者,应与标准 CHOP 化疗(环磷酰胺、阿霉素、长春新碱、强的松)联合治疗。
这是国产首款获批上市的 CD20 单抗,同时也是神州细胞继重组人凝血因子Ⅷ(安佳因)后第二款获批上市的生物药。
瑞帕妥单抗是神州细胞自主研发,结构优化、安全升级的新型抗 CD20 单抗。据神州细胞新闻稿,瑞帕妥单抗采用人抗体天然序列,在重链 CH1 恒定区 219 位点采用的是缬氨酸,为主流序列。该氨基酸序列更广泛地应用于已上市抗体,包括 13 个已上市的 IgG1-G1m17,1 型抗体和 12 个 IgG1-G1m17 和 G1m3 型抗体。奥妥珠单抗、奥法木单抗和阿达木单抗与瑞帕妥单抗在重链恒定区序列完全一致。
据 Insight 数据库显示,瑞帕妥单抗于 2011 年 7 月首次获批临床,2014 年 9 月首次公示临床试验,2019 年 12 月首次申报上市,并于近日获批上市。
瑞帕妥单抗国内项目开发关键节点

来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
此前,神舟细胞披露的瑞帕妥单抗关键注册 III 期临床试验结果表明:瑞帕妥单抗联合 CHOP 治疗 DLBCL 疗效非劣于利妥昔单抗-CHOP 方案,且整体安全性相似。
NCT02772822 临床试验结果

来自:Insight 数据库网页版
进口药重磅新适应症/新剂型获批
上周,阿斯利康的重磅 SGLT2 抑制剂「达格列净」在中国获批新适应症,用于治疗慢性肾病(CK)患者;诺华的 IgE 单抗「奥马珠单抗」获批预充式注射液/在家使用制剂,提升了便利性;默沙东的九价人乳头瘤病毒疫苗新适应症获批上市,在国内将接种年龄从 16 - 26 岁扩大到了 9 - 45 岁,引起热议。
1、阿斯利康「达格列净」获批新适应症
9 月 2 日,NMPA 发布批件批准阿斯利康「达格列净片」新适应症在国内上市,用于有疾病进展风险的慢性肾病(CKD)成人患者(无论这些患者是否患有 2 型糖尿病),以降低估算的肾小球滤过率持续下降、进展为终末期肾病、心血管疾病死亡和心衰住院风险(受理号:JXHS2101074)。
据 Insight 数据库显示,达格列净最早在 2017 年 3 月在国内获批上市治疗 2 型糖尿病。2021 年 2 月,NMPA 批准其第二项适应症,治疗射血分数降低的心力衰竭(HFrEF)成人患者。值得关注的是,适应症的拓展为达格列净带来的糖尿病之后的又一波增量,就 2022 H1 情况来说,达格列净全球销售额同比增长 62% 达到 21.05 亿美元,各区域均呈现超过 50% 的告诉增长。
达格列净项目关键节点

来自:Insight 数据库网页版
达格列净是同类首个钠-葡萄糖协同转运蛋白-2(SGLT2)抑制剂,每日口服一次。据 Insight 数据库显示,目前达格列净已在全球获批 1 型糖尿病、2 型糖尿病、射血分数降低的心衰以及慢性肾病 4 项适应症。
慢性肾脏病(CKD)是一种严重疾病,患者肾功能呈进行性下降(以 eGFR 降低或肾脏损害或两者兼有为标志,并持续三个月以上),影响全球近 8.4 亿人口。
此前,阿斯利康披露了一项达格列净治疗慢性肾脏病患者的国际多中心 III 期 DAPA-CKD 研究数据,研究结果已发表在《新英格兰医学杂志》上 。
该研究结果表明,针对 CKD 2-4 期尿白蛋白排泄升高的患者,达格列净与安慰剂相比,在标准治疗(即血管紧张素转化酶抑制剂或血管紧张素受体阻滞剂)基础上,可降低主要复合终点(包括肾功能恶化、发生终末期肾病、心血管或肾脏死亡)相对风险 39%(p<0.0001),绝对风险(ARR)在中位随访 2.4 年中降低 5.3%。与安慰剂相比,达格列净可显著降低慢性肾脏病患者的全因死亡相对风险达 31%(ARR = 2.1%,p = 0.0035)。
2、默沙东九价 HPV 疫苗扩大使用范围
8 月 30 日,NMPA 发布批件批准了默沙东九价人乳头瘤病毒疫苗新适应症。据默沙东官方新闻稿,本次获批使接种年龄从 16-26 岁扩大至 9-45 岁。(受理号:JXSS2101000)
宫颈癌是常见的妇科恶性肿瘤之一。2021 年 ICO/IARC 中国境内 HPV 及其相关疾病报告显示,2020 年在中国境内 15-44 岁女性中,宫颈癌发病率和死亡率均居于女性肿瘤第三位。
而在中国,约 98% 的宫颈癌由高危型 HPV 导致。根据一项汇总 170 万女性 HPV 感染的流行病学研究显示,中国境内女性最易感染的高危型 HPV 分别为 16/52/58 型。
九价 HPV 疫苗采用三剂免疫程序,适用于预防 HPV16、18、31、33、45、52 和 58 型引起的宫颈癌; HPV6、11、16、18、31、33、45、52 和 58 型引起的宫颈上皮内瘤样病变(CIN1/2/3 级)、宫颈原位腺癌以及持续感染。
3、诺华「奥马珠单抗」获批新剂型
9 月 2 日,NMPA 发布批件批准诺华的创新生物制剂奥马珠单抗(商品名:茁乐®)预充式注射液/在家使用制剂上市,用于 6 岁及以上的儿童、青少年和成人患者,经吸入型糖皮质激素和长效吸入型 β2-肾上腺素受体激动剂治疗后,仍不能有效控制症状的中至重度持续性过敏性哮喘。
此项获批意味着患者无须到院,即可在家注射使用,方便快捷而有效地控制哮喘症状。
奥马珠单抗是全球及国内首个治疗哮喘的靶向生物制剂,直接靶向过敏性哮喘炎症核心 IgE(免疫球蛋白 E),可使 80% 患者改善哮喘及伴随过敏症状,80% 患者无重度急性发作,60% 患者减停口服激素。
据 Insight 数据库显示,早在 2017 年 8 月奥马珠单抗就在国内首次获批上市,用于治疗 12 岁以上经吸入激素合并长效 β2-肾上腺素受体激动剂治疗控制不佳的中重度过敏性哮喘患者(受理号:JXSS1400005)。
此后,今年 4 月该药又获批新适应症,用于治疗采用 H1 抗组胺药治疗后仍有症状的成人和青少年(12 岁及以上)慢性自发性荨麻疹患者(受理号:JXSS2100003),成为目前国内唯一获批用于治疗慢性自发性荨麻疹的生物制剂。
奥马珠单抗国内获批适应症

来自:Insight 数据库网页版
不过,此前在国内上市的注射用奥马珠单抗均为冻干粉制剂,使用前需由医护人员进行溶解,且患者必须由医护人员进行注射治疗。而本次获批了全新给药方式——预充式注射液/在家使用制剂则是很好解决了这个问题,注射前无需溶解,节省医护注射时间,患者亦可自行居家注射治疗,方便快捷。同时,多项研究表明,使用奥马珠单抗预充式注射液/在家使用制剂的疗效显著,与医院注射奥马珠单抗冻干粉制剂无异。
此外,从全球范围来看,奥马珠单抗 2020 年 12 月还在美国获批了慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)适应症,该项适应症暂未在国内获批。
III 期临床新药:又一款国产九价 HPV 疫苗进度推进
不光默沙东九价 HPV 疫苗的接种年龄拓展,上周国产九价 HPV 疫苗同样有发生重要进展者。上海泽润生物的九价疫苗首次启动 III 期临床,离最终成功更近一步(登记号:CTR20222154)。
本次 III 期临床适应症为预防人乳头瘤病毒 6、11、16、18、31、33、45、52、58 型引起的宫颈癌、外阴癌、阴道癌和肛门癌及相关癌前病变、肛门和生殖器病变、宫颈细胞学检查结果异常以及持续感染,主要目的是评价与市售九价疫苗对比 0、2、6 月免疫程序接种后的免疫原性,拟纳入 1200 例 16-26 岁女性。
(注:Insight 数据库仅作新药动态分享,如有需求请咨询联系正规医疗机构)
临床试验信息

来自:Insight 数据库网页版
当前据 Insight 数据库统计,国内已有 4 个九价 HPV 疫苗正在 III 期临床开发中,有望帮助解决疫苗不足之困。
处于 III 期临床阶段的四款国产 HPV 疫苗

来自:Insight 数据库网页版
而除九价疫苗之外,更高价的疫苗研发同样开展得如火如荼。来自国药中生的十一价 HPV 疫苗已经处于 III 期临床,来自神州细胞工程的十四价疫苗也在 II 期临床开发中。IND 阶段还有康乐卫士的十五价疫苗今年 3 月份刚刚获批临床,重庆博唯佰泰生物制药的十七价疫苗 8 月初刚刚申请临床。
首次启动临床新药
上周,国内启动临床新药与获批新药一样迎来了一波「小爆发」。Insight 在此列举 3 款新药做介绍,更多信息可戳 >>Insight 医药情报助手 查询。
1、君实生物 PI3Kα 抑制剂启动临床
8 月 30 日,据 Insight 数据库显示,君实生物/润佳医药的 PI3Kα 抑制剂 JS105(RP903)首次在国内启动临床,用于晚期恶性肿瘤(登记号:CTR20222133)。
试验信息

来自:Insight 数据库网页版
JS105 来源于君实在 2019 年 2 月与润佳医药签订的协议。在该笔合作中,君实以每个药物项目 1.5 亿元技术转让费获得了润佳医药科技 2 款药物的 50% 权益,RP903 即 JS105,是该项交易首款进入 IND 阶段的药物。另一款 JS104 则为泛 CDK 抑制剂。
2021 年 4 月,君实与润佳医药订立合资合同,共同投资设立君实润佳(上海)医药科技有限公司,并由君实润佳在合资区域负责 JS105 项目的研发、临床应用、生产及商业化,两家公司分别拥有君实润佳 50% 的权益。

来自:Insight 数据库网页版
Insight 数据库显示,2022 年 3 月 JS105 首次在国内申请临床,5 月获得临床批准。

来自:Insight 数据库网页版
2、和铂/科伦博泰 TSLP 单抗启动临床
8 月 29 日,Insight 数据库显示,和铂医药和科伦博泰的 HBM9378 注射液(即 SKB378)首次在国内启动临床试验(登记号:CTR20221961)。这是一款 TSLP 抗体,用于治疗哮喘。
试验详情

来自:Insight 数据库网页版
TSLP 是炎症级联反应的启动因子之一,抑制 TSLP 可以从炎症发生的早期进行干预,阻止免疫细胞释放促炎细胞因子。TSLP 与特应性皮炎、哮喘、慢性鼻窦炎等过敏性疾病的发生密切相关,在临床被证明是对低 Th2 型哮喘(约 40% 人群)有效的靶点。
2018 年 4 月,和铂医药与科伦博泰达成全球战略合作,共同研究、开发和商业化新型全人源抗体药物。双方将依托靶点、及全人源单克隆抗体和双特异性抗体平台技术开发全新治疗药物,共同承担临床和商业化的费用,等额分享全球权益和商业利润。同年 8 月,两家公司又达成一笔 3.5 亿美元合作,在该笔合作中和铂获得科伦 PD-L1 抗体 A167 的海外开发权益,这款 PD-L1 单抗日前已在国内申报上市。
和铂医药和科伦博泰的医药交易

来自:Insight 数据库网页版
3、复星医药 TIGIT 单抗启动临床
8 月 30 日,据 Insight 数据库显示,复星医药启动了 TIGIT 单抗 HLX53 国内首个临床试验(登记号:CTR20222158)。
试验详情

来自:Insight 数据库网页版
TIGIT 全称为 T 细胞免疫球蛋白和 ITIM 结构域蛋白,属于脊髓灰质炎病毒受体(PVR)样蛋白家族,是一种主要在免疫细胞(T 细胞)和自然杀伤细胞(NK 细胞)表面表达的免疫检查点蛋白,可抑制这些免疫细胞发挥作用。
HLX53 为复星医药自主研发的创新型抗 TIGIT 的 Fc 融合蛋白,由重链抗体的可变区(VHH)和野生型 IgG1 的 Fc 端组成, 拟用于治疗晚期实体瘤或淋巴瘤。复星医药拟于条件具备后在国内开展 HLX53 针对该适应症的 I 期临床试验。据公告显示,截至 2022 年 5 月,复星医药针对 HLX53 累计研发投入约为人民币 6,490 万 元(未经审计)。
除 HLX53 外,复星医药同时也布局了一款 TIGIT/PD-L1 双抗 HLX301 ,当前正在针对多个瘤种开展 I/II 期临床试验。
HLX301 全球在研进度甘特图

来自:Insight 数据库 (http://db.dxy.cn/v5/home/)

境外创新药进展
本周境外共有 18 款新药(含改良新)研发进度推进到新阶段。其中,阿斯利康 PD-L1 单抗获 FDA 批准一线治疗胆道癌的信息最受关注,因为这项获批使胆道癌一线治疗中首次增加了免疫治疗方案。
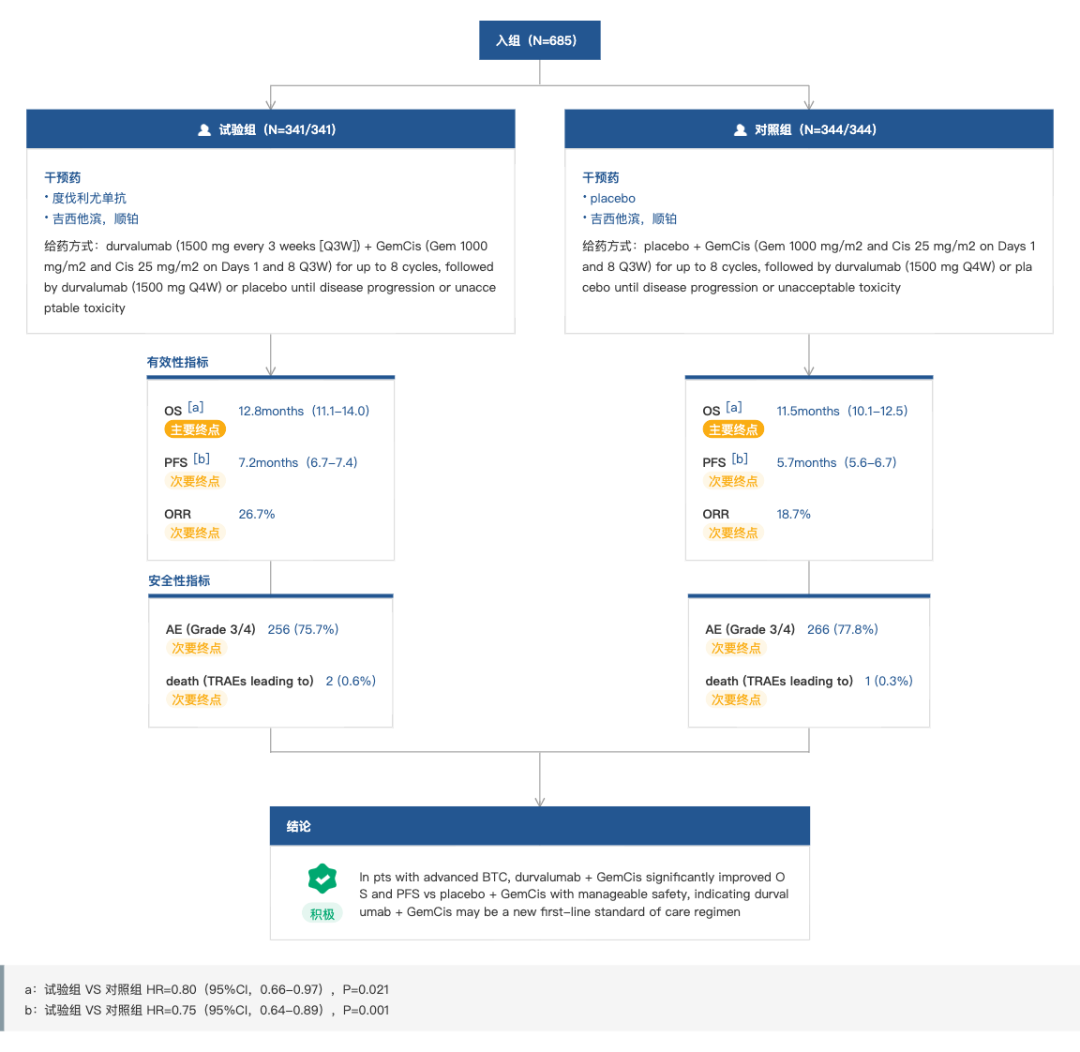
1、度伐利尤单抗:胆道癌免疫疗法首突破






 个人中心
个人中心
 我是园区
我是园区




