
RNA结合蛋白(RNA binding protein, RBP)通过RNA结合结构域结合RNA分子,参与RNA代谢的多个阶段,如选择性剪接、运输、修饰、编辑、翻译等【1,2】,通过转录后调控模式影响多种生理病理过程。然而,已有多项研究表明RBP还可通过与染色质互作调控下游基因表达【3-5】;近期一项利用ChIP-seq分析特定RBP染色质结合能力的研究显示,在K562及HepG2细胞中,某些RBP可与染色质结合【6,7】,提示RBP不仅可与RNA分子结合行使转录后调控,其在染色质环境下也具有独特的调控功能。但是,目前仍未有对染色质富集型RBP的全局性描绘,并且RBP在染色质环境中的调控机制非常复杂,需发展高效且有针对性的高通量鉴定技术或策略。
2021年10月14日,中国医学科学院基础医学研究所余佳团队在Genome Biology期刊在线发表题为 A global screening identifies chromatin-enriched RNA-binding proteins and the transcriptional regulatory activity of QKI5 during monocytic differentiation 的研究论文。该研究首次全局性描绘了造血细胞中染色质富集型RBP的分布图谱,并对其染色质结合机制进行探究,鉴定出RBP QKI5通过转录调控促进单核细胞分化的新机制。

作者首先利用亚细胞组分分离实验,在二种血细胞系K562和THP-1,及293T细胞中分离出染色质组分及可溶性核质组分,通过质谱分析共鉴定出257个染色质结合型RBP,其中52个RBP为三个细胞系共有,定义为染色质富集型RBP,占已注释RBP的9.6%,占染色质互作蛋白的13.8%,说明与染色质结合可能是核内RBP的固有属性。作者接下来筛选了其中造血分化相关的染色质富集型RBP,通过ChIP-seq和CLIP-seq实验对这类RBP的染色质互作机制进行探究,发现造血相关染色质富集型RBP在DNA/RNA不同区域或不同基因类型的分布具有特异性,并且DNA/RNA结合偏好性也各不相同。值得注意的是,这些RBP并不在原位同时结合DNA/RNA,其RNA结合位点通常在DNA结合位点5kb以上范围,提示造血相关染色质富集型RBP不倾向在原位进行转录/转录后协同调控,而是在DNA/RNA水平相对独立地行使不同调控作用。作者进一步对这些造血相关染色质富集型RBP的转录调控作用进行分析,发现QKI5, KHSRP, SETD1A在染色质背景下具有转录调控潜力,而QKI5调控的造血相关基因相对最为富集,且多数为单核分化相关基因,因此作者后续选择在单核细胞分化中对QKI5的功能及调控机制进行研究。
通过在人脐带血来源CD34+造血干祖细胞(HSPCs)中敲低/过表达野生型及RNA结合功能缺陷突变体,作者证明了QKI5可以不依赖于RNA结合的方式促进单核分化。机制上,通过RNase treated ChIP-qPCR实验证明QKI5在染色质上的富集不依赖于RNA分子;并通过QKI5 ChIP motif附近的转录因子(TF)motif筛选结合QKI5 Co-IP质谱分析,证明QKI5不通过相关TF的募集结合染色质。进一步,作者进行了DNA EMSA实验,在体外证明QKI5可直接结合DNA,又同时通过nuclear run-on实验,在体内证明QKI5可控制靶基因的转录起始,结合靶基因新生成转录本检测,揭示QKI5可直接结合染色质促进下游基因转录。最后,作者通过双荧光报告实验及Rescue实验,证明QKI5可通过调控靶基因例如CXCL2的转录,促进单核分化进程。
该研究描绘了造血细胞中RNA结合蛋白的细胞核内分布图谱,系统性筛选出染色质富集型RBP,为后续核内RBP研究提供了开放性高通量数据资源;并首次鉴定出QKI5直接结合染色质促进转录的新机制,丰富了研究者对血液系统RNA结合蛋白功能机制的认识。
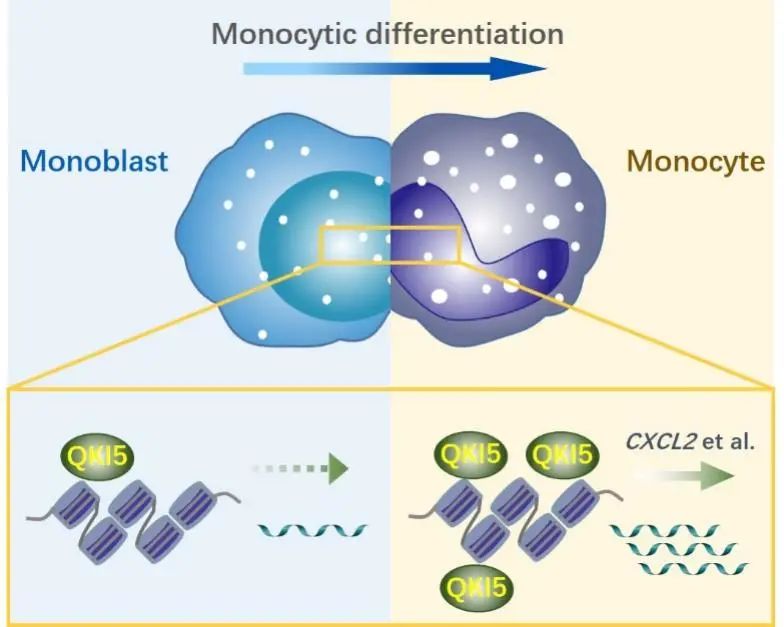
QKI5通过促进下游靶基因表达调控单核分化进程。
中国医学科学院基础医学研究所的余佳教授、王芳教授、王小爽副研究员是本文的通讯作者。中国医学科学院基础所任悦博士、霍悦博士生、李卫倩博士为本文的共同第一作者。
参考文献
1. Glisovic T, Bachorik JL, Yong J, Dreyfuss G: RNA-binding proteins and post-transcriptional gene regulation. FEBS Lett 2008, 582:1977-1986.
2. Lunde BM, Moore C, Varani G: RNA-binding proteins: modular design for efficient function. Nat Rev Mol Cell Biol 2007, 8:479-490.
3. Bi X, Xu Y, Li T, Li X, Li W, Shao W, Wang K, Zhan G, Wu Z, Liu W, et al: RNA Targets Ribogenesis Factor WDR43 to Chromatin for Transcription and Pluripotency Control. Mol Cell 2019, 75:102-116 e109.
4. Barbieri I, Tzelepis K, Pandolfini L, Shi J, Millan-Zambrano G, Robson SC, Aspris D, Migliori V, Bannister AJ, Han N, et al: Promoter-bound METTL3 maintains myeloid leukaemia by m(6)A-dependent translation control. Nature 2017, 552:126-131.
5. Zeng Y, Yao B, Shin J, Lin L, Kim N, Song Q, Liu S, Su Y, Guo JU, Huang L, et al: Lin28A Binds Active Promoters and Recruits Tet1 to Regulate Gene Expression. Mol Cell 2016, 61:153-160.
6. Van Nostrand EL, Freese P, Pratt GA, Wang X, Wei X, Xiao R, Blue SM, Chen JY, Cody NAL, Dominguez D, et al: A large-scale binding and functional map of human RNA-binding proteins. Nature 2020, 583:711-719.
7. Xiao R, Chen JY, Liang Z, Luo D, Chen G, Lu ZJ, Chen Y, Zhou B, Li H, Du X, et al: Pervasive Chromatin-RNA Binding Protein Interactions Enable RNA-Based Regulation of Transcription. Cell 2019, 178:107-121 e118.
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区




