Mol Cell | 石磊/张锴等合作揭示了同源重组的新机制
收藏
关键词:
Cell合作新机制揭示
资讯来源:BioArt + 订阅账号
发布时间:
2022-05-21

责编 | 兮
同源重组
(Homologous recombination,
HR
)
是修复DNA双链断裂
(Double-strand breaks,
DSBs
)
的高保真途径,不仅在基因组稳定性维持中发挥重要作用,也与肿瘤发生发展和放化疗敏感性密切相关
【1】
。HR利用同源序列进行修复,主要活跃在S-G
2
期。HR反应从DNA末端加工开始,产生3’端裸露的单链DNA
(ssDNA)
。复制蛋白A
(Replication protein A,
RPA
)
复合体
(RPA1,RPA2以及RPA3)
迅速包裹ssDNA,然后被重组因子RAD51取代
【2】
。因为RPA对ssDNA的亲和力比RAD51更高,所以RAD51在ssDNA上的组装需要一系列调控蛋白介导。其中,BRCA2是RAD51-ssDNA生成的最经典调节因子
【3】
;此外,组蛋白伴侣分子ASF1和CAF1可以依赖MMS22L-TONSL复合物调节RAD51-ssDNA的形成
【4】
;TOPBP1
(DNA Topoisomerase II Binding Protein 1)
可通过促进PLK1激酶介导的RAD51磷酸化,帮助RAD51结合ssDNA
【5】
。这些研究表明细胞中存在多种独立或相互联系的机制调控RAD51核丝组装。RPA-ssDNA作为HR过程中DNA损伤修复蛋白质机器招募和解离的重要平台,在以往研究中备受关注。然而,是否存在可将RPA沉积和RAD51核丝生成联系起来的中间调控事件,仍需要进一步探究。
2022年5月20日,天津医科大学石磊课题组和张锴课题组在Molecular Cell杂志上合作发表了题为
A PARylation-phosphorylation cascade promotes TOPBP1 loading and RPA-RAD51 exchange in homologous recombination
的研究成果。该研究
探索了多聚 (ADP-核糖) 化和磷酸化级联反应调节同源重组过程中TOPBP1沉积和RPA-RAD51交换的分子机理。
TOPBP1含有多组成对出现的BRCT
(BRCA1 C-terminal)
结构域,它们负责识别不同磷酸化形式的配体蛋白,决定了TOPBP1在复制起始或复制压力应答中的特异性工作模式。然而,在HR倾向性的DSBs染色质区域,TOPBP1是如何被募集的尚不清楚。作者发现HTATSF1
(HIV Tat-specific factor 1)
在复制活跃细胞中高表达,是S期TOPBP1相互作用蛋白;HTATSF1 C端S748位点以CK2激酶依赖的磷酸化形式与TOPBP1 BRCT 0-2结构域结合,BRCT 0-2的K250位点负责阅读S748磷酸化修饰。以往研究表明,K250位点也是TOPBP1识别DDR
(DNA damage response)
分子53BP1和MDC1的关键氨基酸残基。与之不同的是,HTATSF1主要控制S期TOPBP1在损伤染色质上的募集。此外,该事件并不依赖HTATSF1的RNA结合或加工活性。作者进一步研究发现HTATSF1利用N端RRMs
(RNA recognition motif)
识别多聚
(ADP-核糖)
化的RPA,借此将HTATSF1-TOPBP1复合体直接招募到RPA-ssDNA平台,进而促进RAD51
核丝生成和RPA解离。
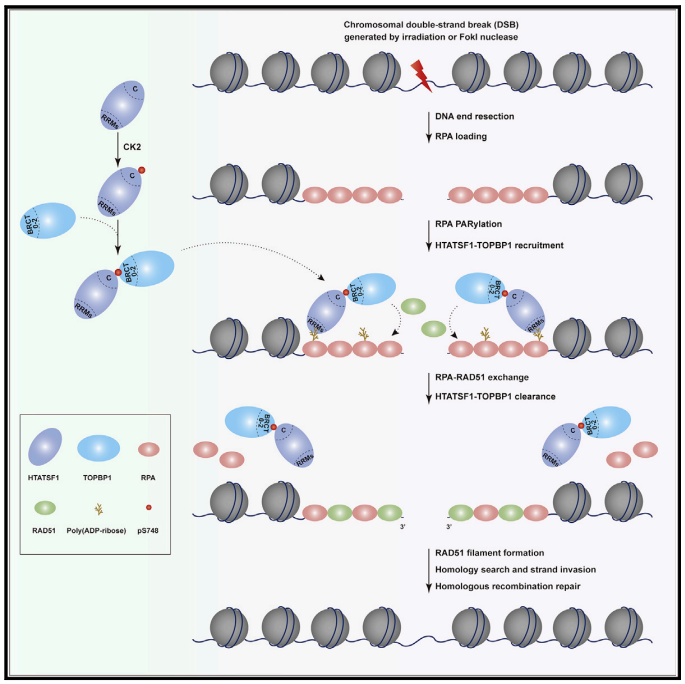 该研究工作模型
综上,
该研究揭示了多聚(ADP-核糖)化和磷酸化级联反应调控TOPBP1在HR倾向性损伤染色质募集以及RPA-RAD51交换中的重要作用,发现了PARP1在HR修复中的新功能,提示TOPBP1 BRCT 0-2磷酸化配体蛋白结合口袋可能成为潜在的肿瘤治疗靶点。
天津医科大学博士研究生赵娇,田姗姗老师,硕士研究生郭秋识和博士研究生包凯文是该论文的共同第一作者。天津医科大学石磊教授、张锴教授和马帅博士为该论文通讯作者。天津医科大学姚智教授、朱毅教授、郝继辉教授、艾玎教授,以及南开大学杨娜教授等为该研究提供了重要帮助和支持。
https://doi.org/10.1016/j.molcel.2022.04.031
该研究工作模型
综上,
该研究揭示了多聚(ADP-核糖)化和磷酸化级联反应调控TOPBP1在HR倾向性损伤染色质募集以及RPA-RAD51交换中的重要作用,发现了PARP1在HR修复中的新功能,提示TOPBP1 BRCT 0-2磷酸化配体蛋白结合口袋可能成为潜在的肿瘤治疗靶点。
天津医科大学博士研究生赵娇,田姗姗老师,硕士研究生郭秋识和博士研究生包凯文是该论文的共同第一作者。天津医科大学石磊教授、张锴教授和马帅博士为该论文通讯作者。天津医科大学姚智教授、朱毅教授、郝继辉教授、艾玎教授,以及南开大学杨娜教授等为该研究提供了重要帮助和支持。
https://doi.org/10.1016/j.molcel.2022.04.031
石磊教授是天津医科大学医学表观遗传学协同创新中心PI,实验血液学国家重点实验室兼聘研究员,教育部青年长江学者特聘教授,国家自然科学基金委优秀青年基金获得者。长期从事基因组稳定性和肿瘤发生发展的表观遗传机制研究,相关研究以通讯作者身份发表在Mol Cell、Genome Biol、J Clin Invest(2篇)、J Exp Med、Sci Adv、Nat Commun(2篇)和Proc Natl Acad Sci U S A等杂志。因课题开展需要,公开招聘博士后研究人员1-2名。要求具备细胞生物学、结构生物学、或者生物信息学等相关领域研究经验,获得博士学位3年之内,年龄不超过35岁,工资待遇可根据申请人资质和能力商议。
1. Sung P, Klein H. Mechanism of homologous recombination: mediators and helicases take on regulatory functions. Nature reviews Molecular cell biology. 2006;7(10):739-50.
2. Jasin M, Rothstein R. Repair of strand breaks by homologous recombination. Cold Spring Harbor perspectives in biology. 2013;5(11):a012740.
3. Davies AA, Masson JY, McIlwraith MJ, Stasiak AZ, Stasiak A, Venkitaraman AR, et al. Role of BRCA2 in control of the RAD51 recombination and DNA repair protein. Molecular cell. 2001;7(2):273-82.
4. Huang TH, Fowler F, Chen CC, Shen ZJ, Sleckman B, Tyler JK. The Histone Chaperones ASF1 and CAF-1 Promote MMS22L-TONSL-Mediated Rad51 Loading onto ssDNA during Homologous Recombination in Human Cells. Molecular cell. 2018;69(5):879-92 e5.
5. Moudry P, Watanabe K, Wolanin KM, Bartkova J, Wassing IE, Watanabe S, et al. TOPBP1 regulates RAD51 phosphorylation and chromatin loading and determines PARP inhibitor sensitivity. The Journal of cell biology. 2016;212(3):281-8.
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。


 该研究工作模型
该研究工作模型


 药选址
药选址

 该研究工作模型
该研究工作模型

