您还不是认证园区!
赶快前去认证园区吧!
▎药明康德内容团队编辑

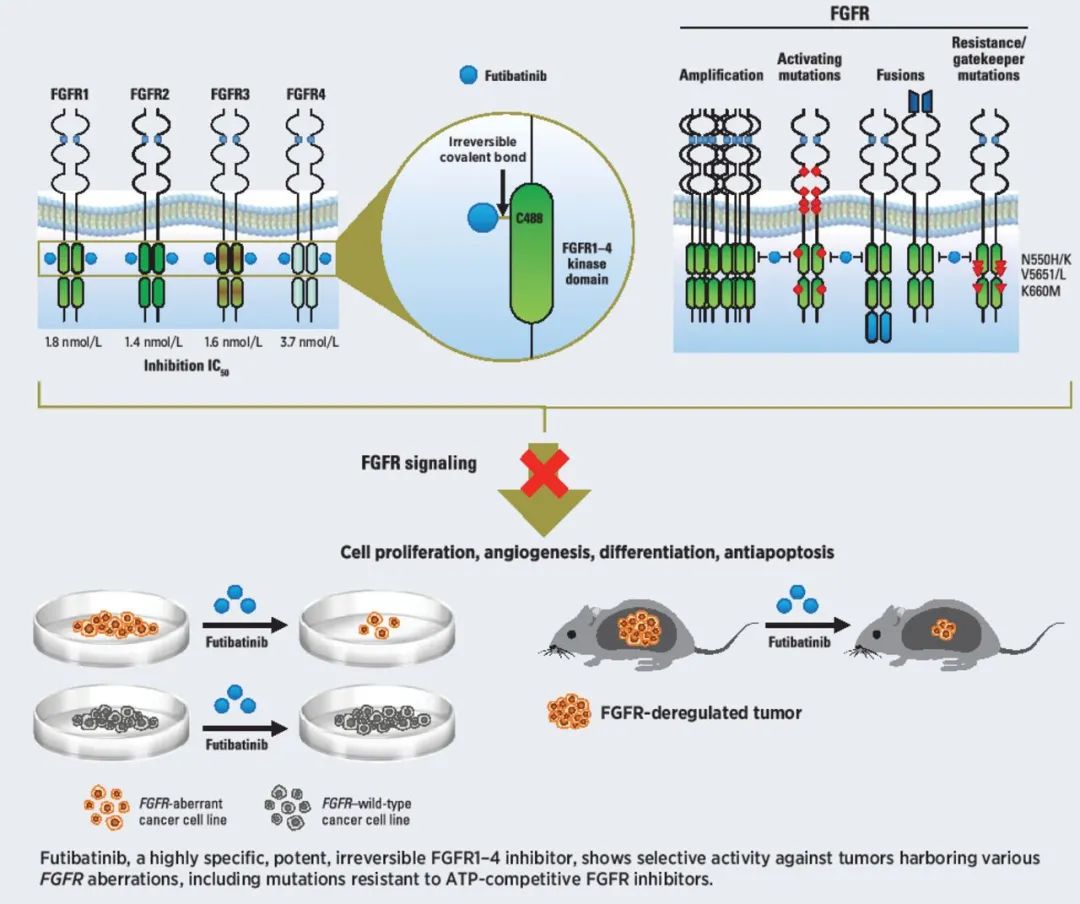
▲Futibatinib的作用机制示意图(图片来源:参考资料[2])
参考资料:
[1] U.S. Food and Drug Administration (FDA) Accepts for Priority Review Taiho Oncology's New Drug Application for Futibatinib for Cholangiocarcinoma. Retrieved March 30, 2022, from https://www.prnewswire.com/news-releases/us-food-and-drug-administration-fda-accepts-for-priority-review-taiho-oncologys-new-drug-application-for-futibatinib-for-cholangiocarcinoma-301513278.html
[2] Sootome et al., (2020). Futibatinib Is a Novel Irreversible FGFR 1–4 Inhibitor That Shows Selective Antitumor Activity against FGFR-Deregulated Tumors. Cancer Research, DOI: 10.1158/0008-5472.CAN-19-2568
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。


分享,点赞,在看,聚焦全球生物医药健康创新



 个人中心
个人中心
 我是园区
我是园区




