一线治疗肝癌!阿斯利康抗CTLA-4+PD-L1联合疗法获批上市
收藏
关键词:
上市治疗疗法获批阿斯利康癌
资讯来源:医药魔方 + 订阅账号
发布时间:
2022-10-24
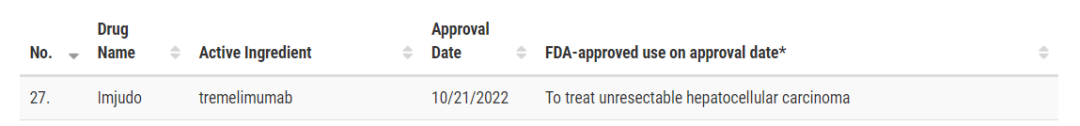
10月21日,FDA官网显示,阿斯利康的抗CTLA-4单抗tremelimumab(替西木单抗)获FDA批准上市,获批适应症为单次启动剂量的tremelimumab与度伐利尤单抗联用一线治疗不可切除的肝细胞癌。该联合用药方案名为STRIDE
(single tremelimumab regular interval durvalumab)
。
肝癌是全球癌症死亡的第三大原因(前二为肺癌和结直肠癌),也是全球第六大最常见的癌症。其中,肝细胞癌(HCC)是肝癌的最常见类型,占75%~85%。在美国,每年约有26000例晚期、不可切除的HCC患者。
tremelimumab是一种由辉瑞开发的人源化单克隆抗体,通过阻断T淋巴细胞表面的CTLA-4的活性,有助于T细胞的活化并增强对肿瘤的免疫应答,从而促进癌细胞死亡。2011年10月,MedImmune(阿斯利康子公司)与辉瑞达成协议,获得tremelimumab的全球开发权,辉瑞则保留开发某些特定联合疗法的权益。2020年1月,STRIDE方案获FDA授予孤儿药资格,用于治疗HCC。
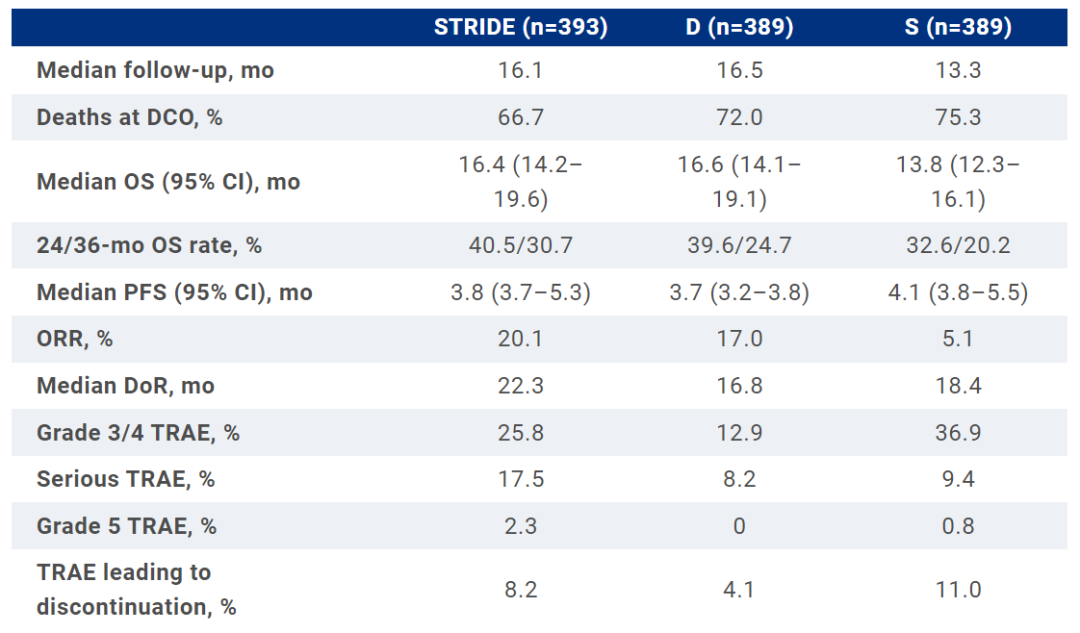
FDA此次批准是基于一项III期HIMALAYA研究的结果。该研究是一项全球性、多中心、随机、开放标签临床试验,共纳入1324例患者,旨在评估STRIDE方案对比度伐利尤单药和索拉菲尼单药治疗不可切除HCC患者的疗效和安全性。这些患者先前未接受过系统治疗且不适用局部治疗。试验的主要终点为总生存期(OS),次要终点包括进展时间(TTP)、无进展生存期(PFS)、客观缓解率(ORR)、疾病控制率(DCR)和缓解持续时间(DoR)。
结果显示,与索拉非尼组相比,STRIDE方案组患者的死亡风险降低了22%(HR:0.78;96.02% CI:0.65-0.93;P=0.0035)。此外,31%的患者在3年内仍存活,而索拉非尼组为20%。
安全性方面,STRIDE方案和Imfinzi单药治疗的安全性与此前报道一致,并且没有发现新的安全信号。
截至近日,全球已有5款CTLA-4单抗获批上市,分别是卡度尼利单抗、贝拉西普、伊匹木单抗、阿巴西普和tremelimumab。此外,齐鲁制药和Sound Biologics合作开发的PSB205、康宁杰瑞的erfonrilimab、默克和康方生物合作开发的quavonlimab正在开展III期临床试验。


 药选址
药选址


