▎药明康德内容团队报道
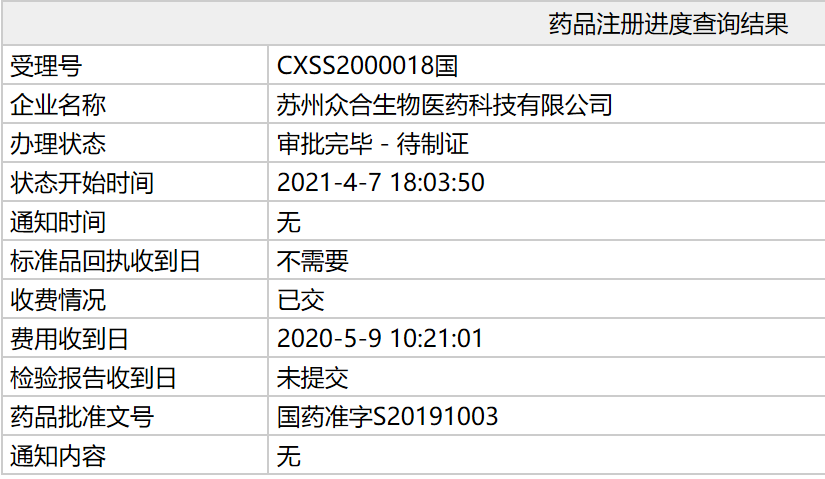
根据中国国家药监局(NMPA)最新公示,由君实生物研发的PD-1抑制剂特瑞普利单抗(拓益)新适应症上市申请(sNDA)审评审批状态已更新为:审批完毕-待制证,批准文号为:国药准字S20191003。这意味着,该新适应症已正式在中国获批。根据受理号信息查询可知,此次获批适应症为:于既往接受系统治疗失败或不可耐受的局部进展或转移性尿路上皮癌。
特瑞普利单抗是一款由君实生物自主研发的抗PD-1单抗药物。
它于2018年12月首次获NMPA批准上市,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗,由此成为中国首个批准上市的以PD-1为靶点的国产单抗药物。2021
年2月,该药物获NMPA批准用于治疗既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)患者,成为全球首个获批鼻咽癌治疗的抗PD-1单抗药物。
根据君实生物早前发布的新闻稿,此次获批尿路上皮癌的新适应症上市申请,是基于一项开放性、单臂、多中心、2期关键注册临床研究(POLARIS-03),该研究旨在评估特瑞普利单抗治疗标准治疗失败后的局部进展或转移性膀胱尿路上皮癌患者的安全性和有效性,由北京大学肿瘤医院郭军教授与上海交通大学医学院附属仁济医院黄翼然教授共同牵头。
根据在2020年2月的美国临床肿瘤学会泌尿生殖系统肿瘤研讨会(ASCO GU)上公布的临床入组结束后的分析数据,至数据截止日,独立评估结果显示:在符合评估条件的148例患者中,总体客观缓解率(ORR)为25.7%,PD-L1阳性患者(46例,31.1%)ORR达到41.3%;OS数据尚未成熟,安全性数据与特瑞普利单抗过往报道基本一致。
值得一提的是,该尿路上皮癌的新适应症上市申请,曾于2020年7月被NMPA药品审评中心(CDE)纳入优先审评,这对于该适应症在中国的获批速度有所加快。

尿路上皮癌是全球范围内最常见的泌尿系统癌症。早期以手术治疗为主,对于不能手术的局部进展或转移性尿路上皮癌患者,以铂类为基础的化疗是其标准的一线治疗,随着化疗敏感性下降,会导致肿瘤复发和疾病进展。对于此类标准治疗后出现疾病进展的晚期尿路上皮癌患者,目前在中国的治疗手段非常有限。
值得一提的是,2021年2月,君实生物已与Coherus BioSciences达成合作,在美国和加拿大共同开发和商业化特瑞普利单抗。今年3月,君实生物与阿斯利康(AstraZeneca)达成商业化合作,授予后者拓益在中国大陆地区后续获批上市的泌尿肿瘤领域适应症的独家推广权,以及所有获批适应症在非核心城市区域的独家推广权。目前,特瑞普利单抗在中国境内外的临床研发正在加速推进,至今已在中、美等多国开展了覆盖超过15个适应症的30多项临床研究,并取得了一定成果。
祝贺君实生物的PD-1抗体特瑞普利单抗在中国获批治疗尿路上皮癌的新适应症,希望该批准能惠及更多患者。
声明:本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转发/复制至其他平台。转发授权请在「医药观澜」微信公众号留言联系我们。
欢迎扫码关注
“
医药观澜
”微信公众号
,了解更多中国医药创新动态。

参考资料:
[1]中国国家药监局药品注册进度查询. Retrieved Apr 7,2021, from http://sq.nmpa.gov.cn/datasearch_nmpa/schedule/search.jsp?tableId=43&tableName=TABLE43&columnName=COLUMN464,COLUMN475&title1=药品注册进度查询
[2]君实生物特瑞普利单抗用于治疗尿路上皮癌患者的上市申请获受理, Retrieved May 7, 2020, from https://mp.weixin.qq.com/s/lRQC8JRdxjBNBzJ3ibAOKA









 个人中心
个人中心
 我是园区
我是园区




