石药集团「盐酸米托蒽醌脂质体注射液」即将获批
收藏
关键词:
药石药获批注射
资讯来源:Insight数据库 + 订阅账号
发布时间:
2022-01-05
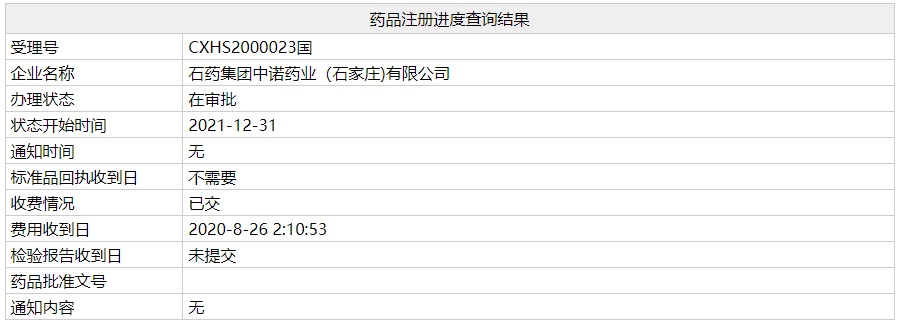
1 月 5 日,NMPA 官网显示,石药集团 2.2 类新药「盐酸米托蒽醌脂质体注射液」上市申请审评状态已变更为「在审批」,有望在近日获批,用于既往至少经过一线标准治疗的复发或难治的外周 T 细胞淋巴瘤(PTCL)患者。点此查看受理号审评状态
盐酸米托蒽醌脂质体注射液是由石药集团子公司中诺药业研发的,具有完全知识产权的改良型新药。目前,全球范围内尚未有相似产品上市,而国内已上市产品均为米托蒽醌注射液,尚无脂质体制剂。
根据石药集团公告,盐酸米托蒽醌脂质体注射液(多恩达®)的上市申请主要基于一项治疗复发/难治外周 T 细胞(r/r-PTCL)和 NK/T 细胞淋巴瘤中的单臂、开放、多中心 II 期临床研究结果。这项临床注册研究表明,多恩达在复发/难治性外周 T 细胞淋巴瘤(R/R PTCL)患者中的客观缓解率(ORR)为 41.7%,完全缓解率(CR)为 23.1%,≥3 个月的 DoR 比率为 84.4%,最长中位持续缓解时间(DoR)为 19.45 个月。无进展生存期(PFS)为 8.5 个月,中位 OS 为未达到,最长 OS 为 26.4 月(54 例仍在 OS 随访中),6 个月的 OS 率为 75%,9 个月的 OS 率为 68.2%。
多恩达®(盐酸米托蒽醌脂质体注射液)在R/R PTCL的OS%
外周 T 细胞淋巴瘤(PTCL)在中国的发病率相对较高,约占非霍奇金淋巴瘤(NHL)的 25%-30%,显著高于欧美国家的发病率(10%~15%)。PTCL 大多数具有侵袭性强,恶性程度高,预后差的特点。然而,目前国内尚无统一的治疗标准,除 ALK+间变性大细胞淋巴瘤(ALCL)应用标准疗法 BV 单抗(维布妥昔单抗)联合化疗效果显著外,PTCL 的其他亚型均预后较差,尚待新的临床治疗选择。
根据 Insight 数据库,截止目前该药共开展了 24 项临床试验,这些临床试验中包括 1 项 3 期临床和 9 项 2 期临床。其中 3 期临床对比了米托蒽醌脂质体单药对比西达本胺单药用于治疗 PTCL 的疗效和安全性,登记于 2020 年 11 月,国内拟入组 190 人。
来自 Insight 数据库(http://db.dxy.cn/v5/home/)
而除了本次申报适应症以外,针对弥漫大 B 细胞和外周 T/NK 细胞淋巴瘤和晚期复发或转移性乳腺癌的 II 期临床也已经完成。其中,治疗晚期乳腺癌的临床试验结果已经在 6 月召开的 2020 年度 ASCO 会议上披露,根据其改善的 ORR、DCR、PFS 以及降低的心脏毒性,或可期待该适应症此后报上市。其他 2 期临床还涉及
晚期肝细胞癌、小细胞肺癌二线治疗等实体瘤适应症。
来自 Insight 数据库(http://db.dxy.cn/v5/home/)
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考来源:石药集团官微,Insight 数据库,NMPA 官网
投稿:微信 insightxb;邮箱 insight@dxy.cn



 药选址
药选址


