Nat Cancer | 赵颖/胡泽平/傅德良团队发现癌症相关成纤维细胞依赖NUFIP1调控核苷分泌促进胰腺癌增殖的新机制
收藏
关键词:
癌症新机制Nat癌细胞
资讯来源:BioArt + 订阅账号
发布时间:
2022-08-19

胰腺导管腺癌
(Pancreatic ductal adenocarcinoma,
PDAC
)
以广泛的纤维性结缔组织增生为特征,其中癌症相关成纤维细胞
(Cancer-associated fibroblasts,
CAFs
)
是肿瘤微环境中最关键的基质细胞之一。多项研究表明,癌症相关成纤维细胞与肿瘤的增殖、转移和化疗耐药密切相关
【1, 2】
。
自噬是一种溶酶体依赖性蛋白质降解过程【3, 4】,在肿瘤微环境中具有重要作用。自噬可以通过多种方式为肿瘤细胞提供营养物质,影响肿瘤细胞的增殖【5】。然而,自噬在癌症相关成纤维细胞中的具体作用还需要进一步的探索。
2022年8月18日,北京大学医学部赵颖团队、清华大学胡泽平团队联合复旦大学附属华山医院傅德良团队在Nature Cancer在线发表了题为
Cancer associated fibroblasts employ NUFIP1-dependent autophagy to secrete nucleosides and support pancreatic tumor growth
的研究论文,
阐述了癌症相关成纤维细胞通过NUFIP1依赖的自噬途径,在胰腺癌肿瘤微环境中分泌核苷,促进胰腺癌细胞增殖的新机制。

自噬
(autophagy)
在肿瘤细胞增殖,转移和耐药中发挥重要作用。为了研究自噬是如何在CAFs中发挥作用并在营养缺乏的肿瘤微环境
(tumor microenvironment)
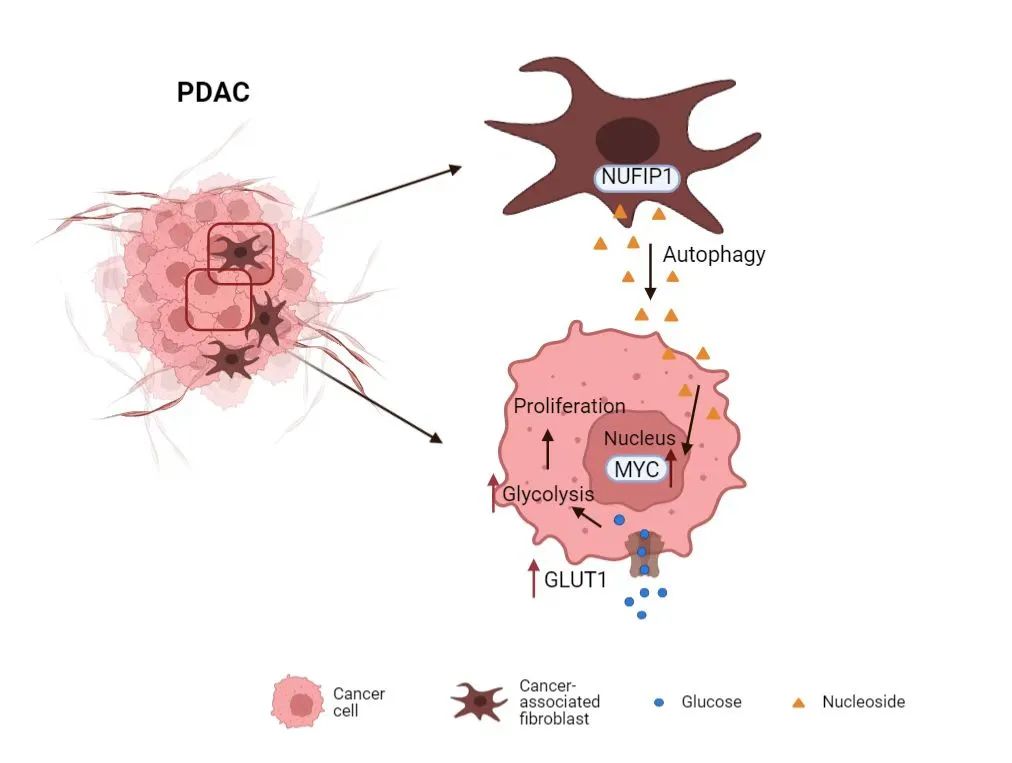
中促进细胞增殖和肿瘤生长的,作者首先发现
NUFIP1
(nuclear fragile X mental retardation–interacting protein 1)
在CAFs促进PDAC的生长中具有关键作用。NUFIP1可以通过调控核糖体RNA的降解释放核苷
(nucleoside)
,而非核糖体蛋白的降解。进一步研究发现,敲除NUFIP1能够抑制CAFs中的核糖体RNA降解,并抑制其分泌核苷,而这会直接影响在谷氨酰胺剥夺下的肿瘤细胞的增殖。同时,作者采用PDAC原位小鼠模型进行体内实验,发现靶向基质成分中的NUFIP1抑制核苷分泌可以使肿瘤重量减轻,恶性程度降低。进一步,在人胰腺癌组织芯片
(Tissue microarray, TMA)
免疫组化染色分析中发现,胰腺癌基质成分中NUFIP1表达水平较低的患者,生存期较长。这些结果表明,CAFs中NUFIP1依赖性自噬对于在谷氨酰胺剥夺下的PDAC的生长至关重要。
有趣的是,核苷作为一种营养物质,并未直接被肿瘤细胞利用,而是通过MYC诱导肿瘤细胞对葡萄糖的消耗。GSEA富集分析发现,在谷氨酰胺缺乏的情况下,CAFs能够上调PDAC细胞中 “MYC targets” 类别基因的表达。进一步实验发现,CAFs分泌的核苷能够促进肿瘤细胞中MYC蛋白的翻译,从而上调肿瘤细胞内MYC蛋白的水平。MYC是调控葡萄糖代谢的重要转录因子,MYC水平的上调,提高了肿瘤细胞对葡萄糖的摄取和利用,缓解了肿瘤细胞在肿瘤微环境中所面对的营养压力。因此,CAFs通过NUFIP1依赖性自噬分泌的核苷提高了PDAC对于葡萄糖的利用,进一步促进了PDAC的生长。
总而言之,
此项工作提出了一个在以往的胰腺癌相关研究中未被重视的代谢网络,揭示了NUFIP1依赖性自噬在CAFs中通过调控核苷分泌影响胰腺癌生长的新机制,证明了自噬在肿瘤微环境中的重要作用,为胰腺癌的靶向治疗提供了新思路。
北京大学医学部基础医学院赵颖教授,清华大学药学院胡泽平研究员和复旦大学附属华山医院傅德良教授为该论文的共同通讯作者。北京大学医学部基础医学院原梦博士生、美国Fred Hutchinson Cancer Research Center涂博博士、复旦大学附属华山医院李恒超医生以及清华大学药学院庞欢欢博士后为该论文的共同第一作者。
赵颖教授实验室目前的研究重点是自噬在胰腺癌肿瘤微环境中的作用,诚邀对自噬感兴趣的优秀博士后/博士生。
https://doi.org/10.1038/s43018-022-00426-6
制版人:十一
1. Pereira, B.A., et al., CAF Subpopulations: A New Reservoir of Stromal Targets in Pancreatic Cancer. Trends Cancer, 2019. 5(11): p. 724-741.
2. Hosein, A.N., R.A. Brekken, and A. Maitra, Pancreatic cancer stroma: an update on therapeutic targeting strategies. Nat Rev Gastroenterol Hepatol, 2020. 17(8): p. 487-505.
3. Klionsky, D.J., Autophagy: from phenomenology to molecular understanding in less than a decade. Nat Rev Mol Cell Biol, 2007. 8(11): p. 931-7.
4. Mizushima, N., Autophagy in protein and organelle turnover. Cold Spring Harb Symp Quant Biol, 2011. 76: p. 397-402.
5. Sousa, C.M., et al., Pancreatic stellate cells support tumour metabolism through autophagic alanine secretion. Nature, 2016. 536(7617): p. 479-83.
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。




 药选址
药选址



