
撰文丨十一月
蛋白质组的测量为生物过程提供了深刻的见解。然而,想要了解细胞中蛋白质组的复杂性以及动态变化、在疾病状态下的变化,并将这种技术变成一个易获取、低造价的方法并不容易。蛋白质组的复杂性质和蛋白质的化学性质为实现与DNA测序技术相当的灵敏度、吞吐量、低成本和高采用提出了基本的挑战【1-2】。直接对单个蛋白质分子进行测序的方法可以提供最大的灵敏度,同时有可能实现单细胞输入、基于读取计数的数字量化、翻译后修饰以及低丰度或异常蛋白形式的检测以及支持广泛采用低成本高吞吐量的要求。为此,美国Quantum-Si公司Brian D. Reed研究组在Science发文题为Real-time dynamic single-molecule protein sequencing on an integrated semiconductor device,提出了一个单分子蛋白质测序的方法以及集成系统可以对蛋白质组学进行研究。

为了实现单分子蛋白质的测序,作者们使用互补金属氧化物半导体制造技术构建了具有纳秒精度的定制时域敏感半导体芯片,包含用于单分子检测的完整集成组件,其中包括光传感器、光波导电路和用于生物分子固定化的反应室(图1)。作者们在反应室底部进行瞬变照明,在高浓度自由扩散蛋白质识别器的情况下实现灵敏的单分子检测。该半导体芯片采用无滤光系统,从而根据光的变化识别不同的氨基酸。
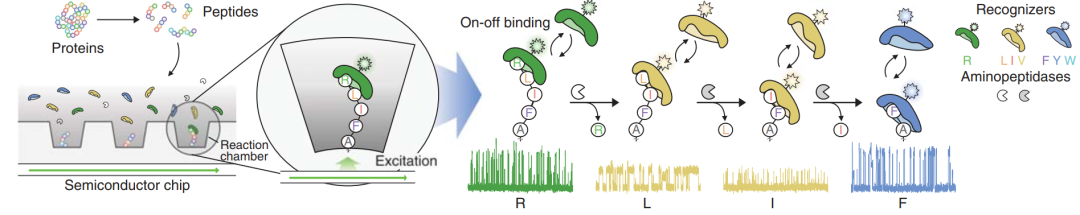
图1 单分子蛋白质实时动态测序
为了对NAA单个氨基酸分子实时的切割以及顺序识别,识别物与多肽形成的复合物必须能够结合足够长的时间,从而产生可以检测的单分子结合事件。作者们首先考虑使用能够自然结合到N端苯丙氨酸(F)、酪氨酸(Y)以及色氨酸(W)的N端适配器家族蛋白ClpS【3-5】。作者们从农杆菌ClpS2中提取到识别器PS610。作者们发现该识别器对于不同NAA的结合动力学不同,比如识别FAA、YAA以及WAA的中位数时间分别是2.49、0.73和0.31秒。这些数值反映了识别器与不同的NAA之间相互作用的不同解离常数以及结合亲和力的差异造成的。
为了扩展可能识别的NAA系列,作者们进一步研究了的N端规则通路蛋白获得新识别器的可能行。通过对不同的ClpS家族蛋白的综合筛选,作者们发现了一组来自phylum Planctomycetes细菌的ClpS蛋白,能够与亮氨酸(L)、异亮氨酸(I)以及缬氨酸(V)结合。通过应用定向进化技术作者们生成了ClpS变种识别器PS961。作者们发现该识别器与N端LAA、IAA和VAA肽结合的中位数时间分别是1.21、0.28和0.21秒。
另外,作者们对泛素连接酶UBR家族中UBR-box结构域进行研究,发现能够天然结合精氨酸(R)、赖氨酸(K)以及组氨酸(H)。作者们该结构域生成识别器PS691,发现识别的精氨酸的中位数时间是0.23秒,但是对赖氨酸以及组氨酸结合亲和力较低。
为了实现对肽链的识别,作者们将肽链FAAWAAYAA与识别器混合,然后加入来自火球菌的氨基肽酶PhTET3,随后收集具有明显的荧光信号以及脉冲动力学信息。作者们发现引入氨基肽酶导致活性反应可以出现一个一个的识别肽段,出现顺序正确且具有预期的动力学特征。通过将不同氨基肽酶以及N端氨基酸识别器进行组合,可以实现对于NAA序列的识别。
为了进一步优化该技术平台,作者们将每种不同氨基酸的裂解时间降低到平均10-40分钟,从而可以提供足够的时间来收集数据,同时避免过长的反应持续时间。为了证明该核心方法以及动力学原理适用于广泛的肽链,作者们对人胰高血糖素样肽GLP-1的片段DQQIASSRLAASFAAQQYPDDD进行合成,根据序列产生的动力学特征,最远可以识别氨基酸位置18的读数,说明该说明该方法与长肽兼容,并能够深入访问肽中的序列信息。
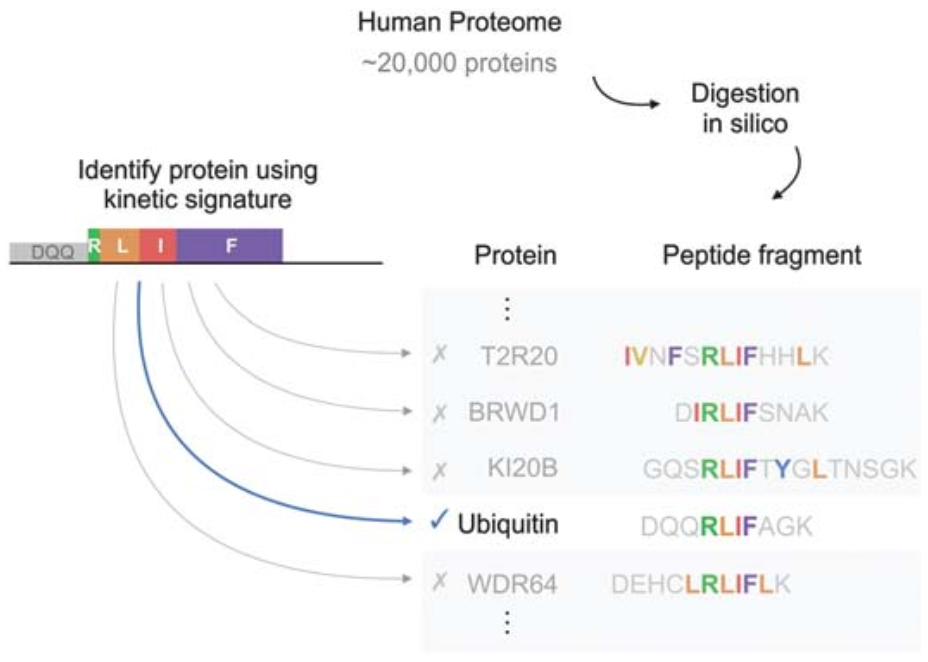
图2 单分子蛋白质测序在人类蛋白质组学上的应用
蛋白质组学的应用需要从生物来源的混合物中识别多肽。为了实现在蛋白质的组学方面的应用,作者们将实验结果扩展到肽链混合物以及生物衍生肽上(图2)。通过混合DQQRLIFAG和RLAFSALGAADDD两个肽链固定在同一个芯片上,作者们发现单分子蛋白质测序的方法可以区分单个肽链,且与单独的测序结果运动特征非常一致。第二,作者们使用76个氨基酸的重组人泛素蛋白以及37个氨基酸的GLP-1,均可以在该芯片平台上产生容易识别和匹配的蛋白酶裂解产物,并映射到目标蛋白上。
总的来说,作者们的工作提出了一个单分子蛋白质测序方法和集成系统进行蛋白质组学研究。该纳米半导体装置通过将蛋白质样本进行氨基酸酶消化,在纳米反应室中进行固定,从而与自由扩散的NAA识别器蛋白结合,产生特征脉冲模式进行测序结果可视化,为单分子蛋白质的测序提供一个高灵敏度的研究平台。
制版人:十一
参考文献
1. S. Goodwin, J. D. McPherson, W. R. McCombie, Nat. Rev. Genet. 17, 333–351 (2016).
2. W. Timp, G. Timp, Sci. Adv. 6, eaax8978 (2020).
3. J. Tullman, N. Callahan, B. Ellington, Z. Kelman, J. P. Marino, Appl. Microbiol. Biotechnol. 103, 2621–2633 (2019).
4. D. A. Dougan, B. G. Reid, A. L. Horwich, B. Bukau, Mol. Cell 9, 673–683 (2002).
5. B. J. Stein, R. A. Grant, R. T. Sauer, T. A. Baker, Structure 24, 232–242 (2016).




转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。




 个人中心
个人中心
 我是园区
我是园区





