
本文作者:Karl
不久前,Excision BioTherapeutics 生物公司公开宣布,在其开展的 EBT-101 的 1/2 期临床试验中,已经有第一位受试者正式开始接受 HIV 的基因治疗。
该受试者于 2022 年 7 月被给药,将持续接受安全性监测,并有望在潜在治愈评估中有资格接受背景抗逆转录病毒治疗(ART)的分析治疗中断(ATI)。

图片来源:Excision BioTherapeutics 官方消息截图
这一消息宣布后不久,加州再生医学研究所(California Institute for Regenerative Medicine, CIRM)宣布资助该生物公司 685 万美元的赠款,以支持 EBT-101 的临床开发。
而专注于艾滋病与热带病研究的多伦多大学的医师科学家 Isaac Bogoch 副教授,则更是在社交网站上直接对 EBT-101 给予「Brilliant」的高度评价,并对这一技术附上了通俗易懂的解释:
「基本上,这是剪掉了艾滋病毒。(Basically this just snips out the HIV.)」
HIV 目前疗法:需坚持终身服药
HIV 早已是医疗界为人熟知的疾病。而最早可以追溯到 19 世纪 60 年代的抗逆转录病毒治疗 (Antiretroviral therapy, ART)的发展,已经挽救无数受困于 HIV 的生命。
ART 让艾滋病这一诊断不再是死刑的宣判——部分控制者能达到「长期缓解」(long-term remission),即像正常人一样生活。
HIV 借用的白血病/淋巴瘤治疗中的概念「长期缓解」,即功能性治愈,也就是不根除病毒,而是将储藏库维持在一个较低的水平,让免疫系统来清除剩余的病毒,或达到一种让病毒不反弹的平衡。

抗逆转录病毒治疗药物原理:抑制病毒进入、抑制蛋白酶、抑制整合酶、抑制逆转录酶(图片来源:维基百科)
也因此,ART 治疗存在「需要坚持终身服药」的问题,甚至,累积合并症的风险增加,全球范围内还持续缺乏的统一药物可及性。
相关专家都强调「艾滋病毒治愈」的必要性,于是 HIV 病毒储存库变成了 HIV 治愈绕不开的热门话题。
HIV 病毒库,是一种细胞类型或解剖部位,病毒的可复制形式与该细胞类型或解剖部位相关,并以比主动复制病毒的主要库更稳定的动力学特性持续存在。[1]
更通俗的解释是,HIV 病毒通过逆转录合成 DNA,DNA 被整合入静息和活化的淋巴细胞以及巨噬细胞中。在免疫反应和抗逆转录病毒治疗的影响下,细胞内的病毒 DNA 能够以类似休眠的状态,稳定地持续存在。有类似功能的组织和细胞,都被称为 HIV 病毒储存库。

也正是因为病毒储存库的存在,ART 不能永久消除病毒并治愈由病毒感染引起的疾病,并且 HIV 感染者在 ART 中断后的数周内,可能会经历病毒载量反弹。
如果可以解决病毒储存库的问题,则可能突破这个关卡。
EBT-101,如成功将一次治愈?
提及「艾滋病治愈」的消息,大家并不陌生。
从第一位「柏林病人」到第二位「伦敦病人」,两位同时患有艾滋病和血液系统肿瘤的病人,在接受源于 CCR5-delta32 捐赠者的造血干细胞移植后,不仅治愈了肿瘤,血液内也再没有发现艾滋病病毒。
根据学界观点,CCR5 是 HIV 病毒入侵 T 细胞的主要受体,携带有 CCR-delta32 这一突变的人群能够对 CCR5 嗜性 HIV 病毒免疫。[3]
只不过,造血干细胞移植的高花费、高死亡率、严格适应症,让这一方法并没有成为主流治疗艾滋病的技术。
而 EBT-101 似乎代表了某种更加普适性的可能——就像 Isaac Bogoch 博士说的那样,EBT-101 这一技术可以剪掉 HIV 病毒储存库上的前病毒。
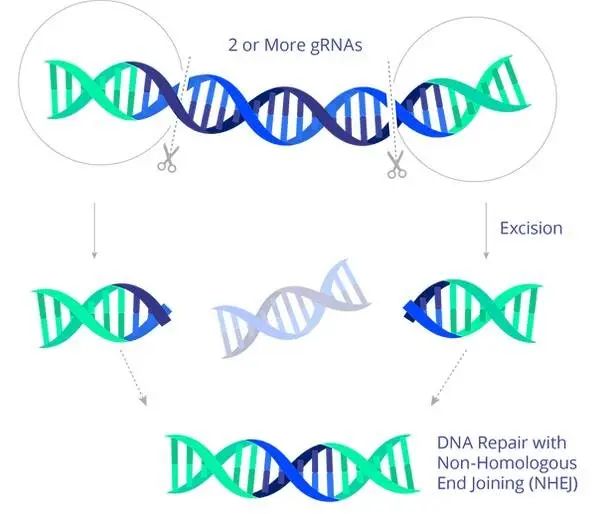
这把魔剪,就是 CRISPR-Cas 9 基因编辑技术,递送这把剪刀的包裹是腺相关病毒(adeno-associated virus,AAV)。
长期非人类灵长类动物安全数据和人源化小鼠的疗效数据显示,用这一治疗技术有可能治愈 HIV。[4]
如果拿 MOBA 游戏打比方,「长期控制」是手动补兵,「干细胞移植」是有自动补兵的外挂,而「基因编辑」则是直接推塔。
2019 年,CCR5 的发现者,北京大学邓宏魁教授的研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组合作,曾在 ΝΕJM 发表了题为 CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia [5] 的研究,报道了使用 CRISPR 技术编辑造血干细胞中的 CCR5 后进行移植以规避伦理学和安全问题的方法,并指出该方法有望将「柏林病人」和「伦敦病人」量产,帮助更多的艾滋病患者。

尽管研究中的编辑效率尚且不高,但该技术的安全性和潜力已经在研究中得到证实。
仍需探索验证的「魔剪」
CIRM 总裁兼首席执行官 Maria T. Millan 医学博士表示:「迄今为止,只有少数人治愈了 HIV/AIDS,因此使用基因编辑消除病毒的提议可能具有变革性。」
「仅在加利福尼亚,就有近 140,000 名艾滋病毒携带者。艾滋病毒感染继续不成比例地影响边缘化人群,其中许多人无法获得控制病毒的药物。艾滋病毒的功能性治愈将对这些社区以及世界各地的其他社区产生巨大影响。」
在这样乐观的态度下,「魔剪」在踏出一条新路的同时,依旧充满挑战。
比如,实施 CRISPR/Cas9 进行基因治疗的一个主要问题是脱靶效应(off-target effect, OTE))的频率相对较高。Cas9 的引导 RNA (gRNA) 识别 20bp 的目标 DNA 序列,它结合并切割该序列以「编辑」DNA 序列。然而,靶序列结合可以容忍多达几个碱基对的错配,这意味着通常存在数千个可能的结合位点,这会带来很大的问题。[6]
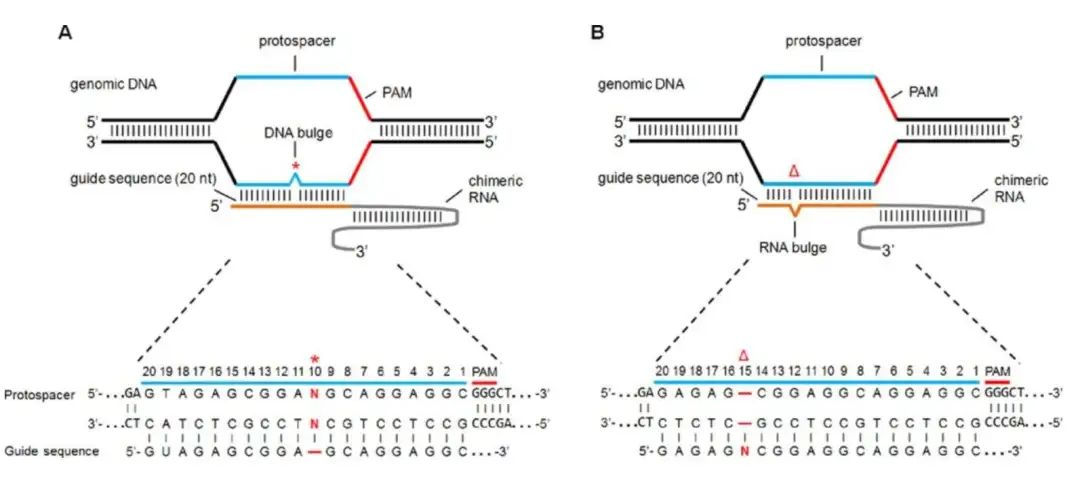
此外,还有 DNA 损伤毒性和免疫毒性等问题。[7]
好消息是 2021 年 6 月,新英格兰杂志公布了首个体内 CRISPR-Cas 9 基因编辑疗法的临床试验结果——这一技术在 6 名转甲状腺素蛋白淀粉样变性的患者中安全有效。[8] 也侧面说明,这一技术的风险能被科学家控制在相对较低的水平。
而如果把 CRISPR-Cas9 比作高处,其实很多疾病的治疗方向都可以有更多发散方向。如在治疗方法上总是争当弄潮儿的血液科,同样的技术也有望应用于镰刀型贫血症的治疗。[9]
Excision BioTherapeutics 官网也显示,会在乙肝病毒和 HSV 中尝试类似疗法的探索。

图片来源:Excision BioTherapeutics 官网
从更长的时间周期来看,基因编辑技术的研究热是件好事,而如何基于已经有的研究,去进行合规的新疗法摸索,是当代临床医生持续要做的事情。
致谢:本文经 首都医科大学附属北京佑安医院感染综合科主任医师 李侗曾 专业审核
点击卡片进入 Insight 小程序
药品申报、临床、上市、一致性评价…
随时随地查!
👇👇👇
免责声明:本文仅作消息分享,并不构成投资建议,也不代表 Insight 数据库的立场,文章观点仅供分享行业见解,请广大投资者谨慎。
本文首发于丁香园公众号;
策划:carollero | 监制:gyouza | 编辑:Hebe;
PR 稿对接:微信 insightxb;
投稿:微信 insightxb;邮箱 insight@dxy.cn;

点击阅读原文
免费试用 Insight 数据库



 个人中心
个人中心
 我是园区
我是园区




