尽管已经对HIV疫苗进行了数十年的研究,仍然求之未果。庆幸的是,人们发现一些HIV感染者可以产生能够有效中和大部分HIV-1分离株的广泛中和抗体
(
bnAbs
)
,HIV bnAbs表现出的特征如长重链第三互补决定区
(
HCDR3s
)
、高发生率的体细胞超突变
(
SHM
)
、插入和缺失
(indel)
以及多反应性或自身反应性等使得疫苗接种具有挑战性
【1-3】
。种系靶向
(GT)
方法利用合理设计的免疫原来启动B细胞,该种B细胞编码具有发展为bnAbs潜力的种系抗体,可能会克服上述问题
【4, 5】
。因此,需要临床前体内模型来表征特定人类B细胞克隆的激活和成熟,以可重复地研究GT免疫原诱导的抗体进化。
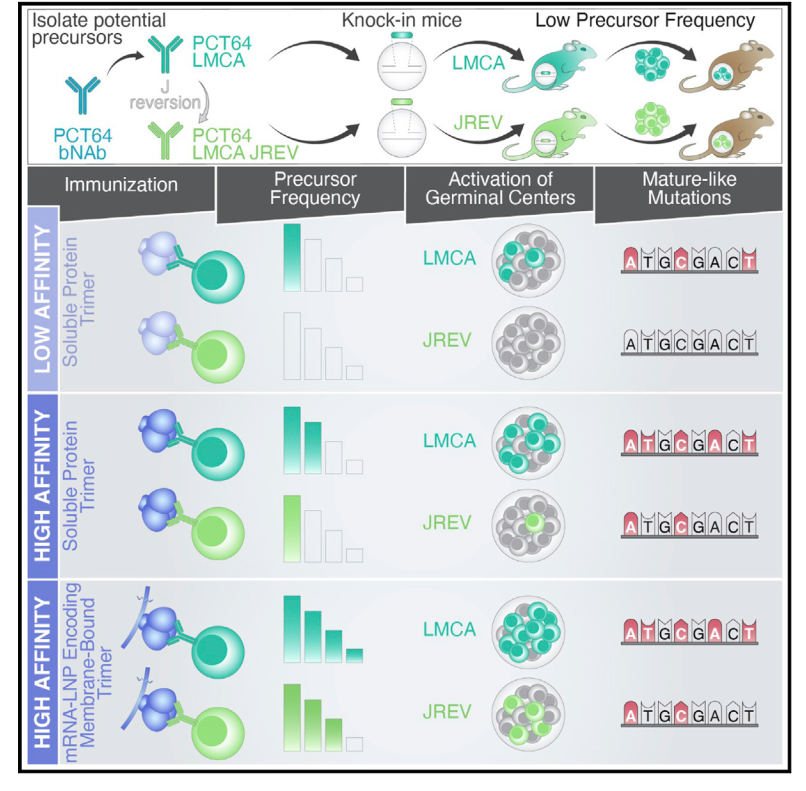
近日,来自美国Moderna Inc.的Facundo D. Batista团队、麻省理工学院-哈佛大学的William R. Schief团队在Immunity杂志上发表了一篇题为
Membrane-bound mRNA immunogens lower the threshold to activate HIV Env V2 apex-directed broadly neutralizing B cell precursors in humanized mice
的文章,他们构建了表达bnAbs PCT64的种系B细胞受体
(BCR)
的KI小鼠模型,ApexGT 免疫原对PCT64种系BCR的高亲和力对于以人类生理频率特异性激活KI B细胞、将它们募集到生发中心
(GCs)
并选择成熟的bnAbs突变是必要的。他们证明,
相对于蛋白质,mRNA编码的膜结合ApexGT免疫显着增加了PCT64前体向生发中心的激活和募集,并降低了它们的亲和力阈值。总之,这项工作验证了ApexGT免疫原用于引发V2-apex bnAbs前体,并将mRNA-LNP确定为显着改善B细胞反应的免疫原递送方法。
为了研究体内针对HIV-1 Env的Apex的免疫反应,作者构建了表达从人类供体中分离出来的bnAbs PCT64的B细胞KI小鼠,为评估是否能表达功能性BCR,作者测定了抗原与ApexGT2
(以下简写GT2)
三聚体探针的特异性结合,双荧光染色显示约58%的外周血B细胞与GT2结合。随后,作者想知道GT2在体内激活该B细胞的能力,采用过继转移系统对受体小鼠进行B细胞免疫接种,用GT2三聚体免疫的WT小鼠未能产生表位特异性IgG抗体,而在接种小鼠中成功激活PCT64LMCA B细胞且形成持续的GC反应。通过单细胞BCR测序,作者发现在接受GT2三聚体免疫后可以成功启动PCT64LMCA向更高亲和力和成熟的 PCT64 样抗体成熟,82.6%的幼稚B细胞表达PCT64LMCA IGH
(重链)
序列。
免疫原亲和力是B细胞活化的关键,为了评估亲和力对激活的影响,作者另外用一种对PCT64LMCA具有更高亲和力的ApexGT5
(下面简写未GT5)
三聚体来免疫小鼠,在与GT2的结果进行比较后发现CD45.2+ B细胞募集到GC的相对增加,且差距在最低前体频率时最为明显,GT5免疫激活的B细胞比GT2多约20倍。为了确定GT5是否可以在PCT64前体中诱导SHM,作者以42 dpi对CD45.2+ GT5+ IgG1+ B细胞进行分类以进行单细胞BCR测序,IGH和IGK
(轻链)
序列都显示出多样化,但尤其可以在IGH中诱导可中和病毒的PCT64样突变。
用于SARS-CoV-2的核苷修饰mRNA疫苗已被证明对人类安全且高效,因此,GT5被进一步开发为具有从DNA或mRNA表达的适当抗原谱的膜结合三聚体。由于人类疫苗经常采取肌肉注射
(IM)
,于是作者在注射GT5蛋白三聚体后检测腹股沟淋巴结的反应。然而,无论在GCs中还是在血清中都未能检测到GT5 特异性 CD45.2+ B细胞。于是,作者用单剂量的编码GT5的mRNA-LNP进行肌肉注射,能够诱导持久的GT5特异性抗体,且BCR测序结果表明mRNA-LNP GT5 仍然保持诱导PCT64样突变的能力。此外,作者还发现如果分别用编码 GT5的mRNA-LNP或10mgGT5可溶性蛋白免疫受体小鼠,在13 dpi时, mRNA 免疫小鼠中存在具有强 PCT64LMCA.JREVH B细胞募集的GC反应,但在蛋白质免疫小鼠中未检测到 PCT64LMCA.JREVH B细胞活化,提示mRNA编码的 GT5可能会降低前体激活的亲和力阈值。
总之,
这项工作验证了针对V2-apex表位的以HCDR3为中心的GT免疫原设计,并证明了mRNA-LNP的效用。由于mRNA可以简化多种结构合理的免疫原的传递,因此这项工作与处于临床测试各个阶段的一系列GT疫苗候选者一起,可能有助于开发多组分HIV疫苗。
原文链接:
https://doi.org/10.1016/j.immuni.2022.09.003
1. Klein, F., Mouquet, H., Dosenovic, P., Scheid, J.F., Scharf, L., and Nussenzweig, M.C. (2013). Antibodies in HIV-1 vaccine development and therapy. Science 341, 1199–1204. https://doi.org/10.1126/science.1241144.
2. Burton, D.R., and Hangartner, L. (2016). Broadly neutralizing antibodies to HIV and their role in vaccine design. Annu. Rev. Immunol. 34, 635–659. https://doi. org/10.1146/annurev-immunol-041015-055515.
3. Kelsoe, G., and Haynes, B.F. (2017). Host controls of HIV broadly neutralizing antibody development. Immunol. Rev. 275, 79–88. https://doi.org/10.1111/ imr.12508.
4. Rappuoli, R., Bottomley, M.J., D’Oro, U., Finco, O., and De Gregorio, E. (2016). Reverse vaccinology 2.0: human immunology instructs vaccine antigen design. J. Exp. Med. 213, 469–481. https://doi.org/10.1084/JEM.20151960.
5. Steichen, J.M., Kulp, D.W., Tokatlian, T., Escolano, A., Dosenovic, P., Stanfield, R.L., McCoy, L.E., Ozorowski, G., Hu, X., Kalyuzhniy, O., et al. (2016). HIV vaccine design to target germline precursors of glycan-dependent broadly neutralizing antibodies. Immunity 45, 483–496. https://doi.org/10. 1016/j.immuni.2016.08.016.

【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。











 个人中心
个人中心
 我是园区
我是园区





