【创新药与临床研究】
10.09,【CDE】关于公开征求《临床试验中药物性肝损伤的识别、处理及评价指导原则》意见的通知
10.09,【CDE】关于公开征求《基因治疗血友病临床试验设计技术指导原则(征求意见稿)》意见的通知
10.09,【CDE】关于公开征求《肿瘤治疗性疫苗临床试验技术指导原则(征求意见稿)》意见的通知
【药学研究与仿制药】
10.09,【CDE】关于发布《阿司匹林肠溶片生物等效性研究技术指导原则》的通告(2022年第36号)
10.09,【CDE】关于公开征求《化学仿制药参比制剂目录(第六十三批)》(征求意见稿)意见的通知
10.10,【CDE】关于公开征求《非无菌化学药品及原辅料微生物限度研究技术指导原则(征求意见稿)》意见的通知
【注册,审评,审批】
10.10,【NMPA】关于发放药品电子注册证的公告(2022年 第83号)
10.11,【NMPA】关于启用生物制品批签发电子证明、麻醉药品和精神药品实验研究立项电子批件的公告(2022年第84号)
10.14,【NMPA】关于暂行延长药品注册申请补充资料时限的公告(2022年第86号)
10.16,CDE 药品审评报告和说明书更新,其中包括下列国产新药
【监管综合】
10.10,【NMPA】关于发布医疗器械注册质量管理体系核查指南的通告(2022年第50号)
【新药批准和报产】
10.03-10.16,NMPA发布16个新药批准,CDE受理7个NDA
(内容导读请在下列文本框中上下滑动查看,法规原文可点击跳转识林小程序直接阅读)
【创新与临床研究】
10.09,【CDE】关于公开征求《临床试验中药物性肝损伤的识别、处理及评价指导原则》意见的通知
药物性肝损伤(Drug-Induced Liver Injury,DILI)是指由各类化学药品、生物制品、传统中药及其代谢产物乃至辅料等所诱发的肝脏损伤。本指导原则提出了DILI的监测、评估及处理程序框架,主要用于指导药物临床试验中DILI风险的临床评价,目的在于保障受试者安全,同时获得安全性信息以评估试验药物的风险特征。
本指导原则适用于化学药品和生物制品。
10.09,【CDE】关于公开征求《基因治疗血友病临床试验设计技术指导原则(征求意见稿)》意见的通知
该指导原则与国内外相关技术要求如美国 FDA 于 2020 年发布的《血友病基因治疗产品指南》等较为一致。概述起草背景,从基因治疗临床试验设计的关键要素出发 , 对整体临床试验设计、受试者的选择、有效性终点、对受试者的监测、统计学考虑等方面 , 进行阐述。
本指导原则适用于基因治疗产品。本指导原则实施后能立即见效 , 有助于指导基因治疗血友病临床试验的设计与开展。
10.09,【CDE】关于公开征求《肿瘤治疗性疫苗临床试验技术指导原则(征求意见稿)》意见的通知
肿瘤治疗性疫苗是指通过诱导或增强机体针对肿瘤抗原的特异性主动免疫反应,从而达到控制和杀伤肿瘤细胞、清除微小残留病灶以及建立持久的抗肿瘤记忆等治疗目的一类产品。这类产品的作用机制是通过抗原呈递细胞(APC)将抗原加工并呈递给T细胞,从而诱导产生或放大已存在的抗原特异性T细胞反应,这一系列的免疫反应过程需要较长时间。与传统细胞毒药物、靶向治疗或其它肿瘤免疫治疗药物相比,肿瘤治疗性疫苗的临床试验设计存在诸多不同考虑。
【药学研究与仿制药】
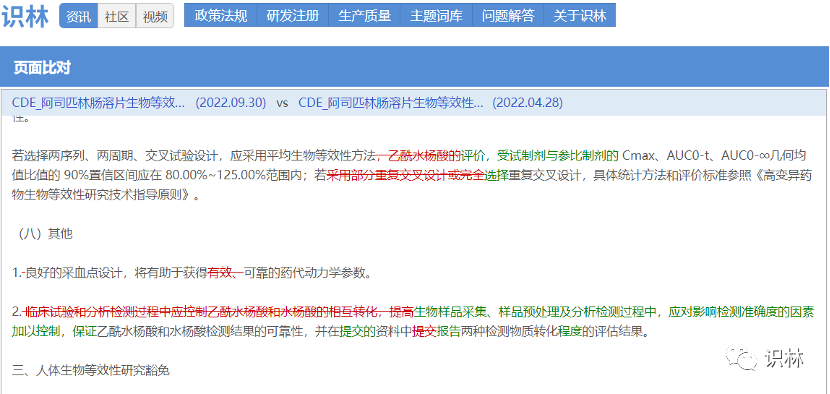
10.09,【CDE】关于发布《阿司匹林肠溶片生物等效性研究技术指导原则》的通告(2022年第36号)
阿司匹林肠溶片(Aspirin enteric-coated tablets)是一种延迟释放制剂,其主要成份乙酰水杨酸在吸收前、吸收期间和吸收后,可转化成主要代谢产物水杨酸,代谢产物主要经肾脏途径排泄。乙酰水杨酸的消除半衰期很短,水杨酸的消除速率受给药剂量的影响。
相对于4月份征求意见,“页面比对”工具可发现下列修订内容:
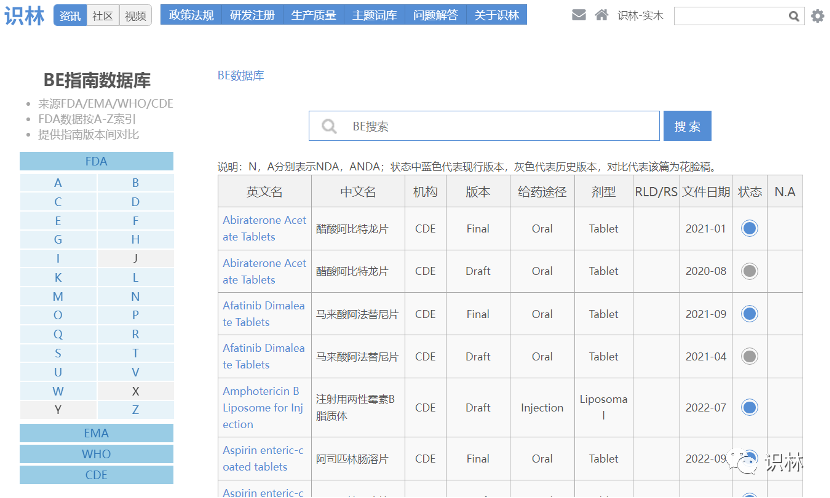
10.09,【CDE】关于公开征求《化学仿制药参比制剂目录(第六十三批)》(征求意见稿)意见的通知
截至目前,国内参比制剂目录已发布六十批,公示六十三批。
用户可至识林“中国化学仿制药参比制剂目录公示批列表” 和“参比制剂数据库”查询。
10.10,【CDE】关于公开征求《非无菌化学药品及原辅料微生物限度研究技术指导原则(征求意见稿)》意见的通知
对于非无菌化学药品及原辅料,微生物限度是反映产品安全性和质量可控性的重要指标之一。目前在非无菌化学药品及原辅料申报过程中主要存在以下问题:未对微生物限度进行研究且未提供相应的风险评估资料;申报资料中微生物限度检查相关内容不规范、不完善,进口药品中检测方法与菌种来源不匹配等。上述问题对产品质量控制和评价以及后续质量标准复核可能产生较大影响。
本指导原则主要内容包括概述、非无菌原辅料微生物限度研究、非无菌化学药品微生物限度研究、微生物限度研究的其他关注点、微生物限度申报资料要求、名词术语及参考文献七个部分。
【注册,审评,审批】
10.10,【NMPA】关于发放药品电子注册证的公告(2022年 第83号)
11月1日起,多个常用批件、证书正式进入电子时代。
药品电子注册证发放范围为自2022年11月1日起,由国家药监局批准的药物临床试验、药品上市许可、药品再注册、药品补充申请、中药品种保护、进口药材、化学原料药等证书以及药物非临床研究质量管理规范认证证书。
药品电子注册证与纸质注册证具有同等法律效力。电子证照具有即时送达、短信提醒、证照授权、扫码查询、在线验证、全网共享等功能。
药品上市许可持有人或申请人须先行在国家药监局网上办事大厅注册并实名认证,进入网上办事大厅“我的证照”栏目,查看下载相应的药品电子注册证。也可登录“中国药监APP”,查看使用电子注册证。
药品电子注册证不包含药品生产工艺、质量标准、说明书和标签等附件。上述附件以电子文件形式和药品电子注册证同步推送至国家药监局网上办事大厅法人空间“我的证照”栏目,推送成功即送达,药品上市许可持有人或申请人可自行登录下载获取。
药品上市许可持有人或申请人应妥善保管国家药监局网上办事大厅账号、电子注册证及相关附件电子文件等。
药品电子注册证使用相关问题可查看国家药监局网上办事大厅“电子证照常见问题解答”栏目。
10.11,【NMPA】关于启用生物制品批签发电子证明、麻醉药品和精神药品实验研究立项电子批件的公告(2022年第84号)
自2022年11月1日起,正式启用生物制品批签发电子证明、麻醉药品和精神药品实验研究立项电子批件。
10.14,【NMPA】关于暂行延长药品注册申请补充资料时限的公告(2022年第86号)
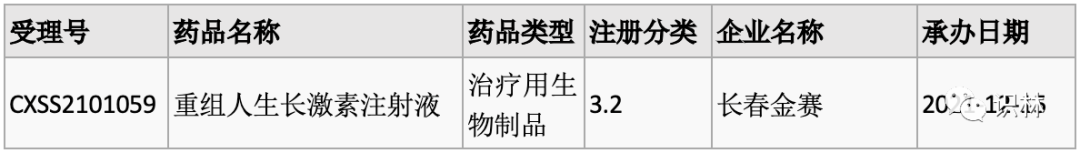
10.16,CDE 药品审评报告和说明书更新,其中包括下列国产新药
【监管综合】
10.10,【NMPA】关于发布医疗器械注册质量管理体系核查指南的通告(2022年第50号)
【新药批准和报产】
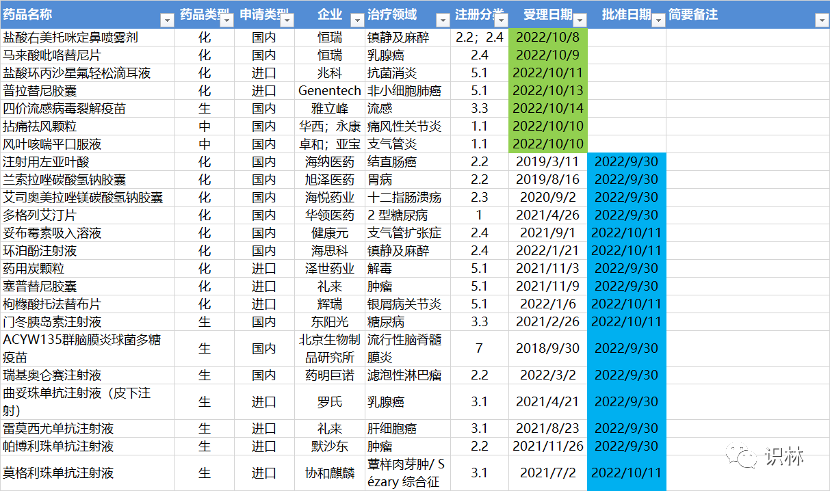
10.03-10.16,NMPA发布16个新药批准,CDE受理7个NDA
点击下方卡片,快速绑定/注册识林小程序
长按下方二维码下载识林®App

识林®版权所有,未经许可不得转载



 个人中心
个人中心
 我是园区
我是园区




