“肾癌文献月评项目”秉承传递最新医学进展的理念,以专业视角多维度关注领域最新进展。为了促进肾癌领域疾病认知和学术提升,诺华医学部启动肾癌文献月评项目,成立以CUA青委为主专家点评组,以此结合中国实践进行深入点评,本期为肾癌文献月评第十二期。
本期汇总了2021年2-3月发表的热点高水平研究,围绕肾癌靶向药物临床研究、预后预测因素、免疫及抗血管生成药物等相关内容展开,特别邀请北京大学人民医院叶雄俊教授为我们带来深入解读。

叶雄俊 教授
北京大学人民医院 泌尿外科
主任医师,博士研究生导师,副教授
美国梅奥医学中心(Mayo Clinic)和加州大学旧金山医学中心(UCSF)访问学者
德国纽伦堡医学中心泌尿外科客座教授
CUA青委会微创学组委员
CUA青委会科学普及组委员
中国研究型医院泌尿外科青委会副主任委员
中国自动化学会医学机器人专业委员会委员
中国医促会腔镜学会委员
CSCO尿路上皮癌委员会委员
北京市抗癌协会泌尿肿瘤青委会副主任委员
北京市健促会泌尿外科青委会副主任委员
北京医师协会泌尿外科专科医师分会常务理事
北京肿瘤学会泌尿肿瘤专委会委员
《中华泌尿外科杂志》通讯编委,《泌尿外科杂志(电子版)》编委,《Current Opinion in Urology》中文版编委,《北京大学学报(医学版)》审稿专家
舒尼替尼与卡博替尼、克唑替尼、沃利替尼治疗晚期乳头状肾细胞癌的对比研究:一项随机、开放标签、II期试验

背景:肝细胞生长因子受体(MET)是乳头状肾细胞癌(PRCC)的关键驱动因素。鉴于转移性PRCC尚无最佳治疗方法,本研究旨在比较现有的治疗标准舒尼替尼与MET激酶抑制剂卡博替尼、克唑替尼、沃利替尼治疗PRCC患者的疗效。
方法:在美国和加拿大的65个中心进行了一项随机、开放标签的临床II期研究(NCT02761057),纳入年龄≥18岁、既往接受过≤1次治疗 [不包括血管内皮生长因子(VEGF)和MET靶向药物] 的转移性PRCC患者。将患者随机分组,分别接受舒尼替尼、卡博替尼、克唑替尼或沃利替尼治疗,并根据既往治疗和PRCC亚型进行分层。所有药物均为口服:舒尼替尼50 mg,连服4周,停药2周(允许减量至37.5 mg和25 mg);卡博替尼60 mg/d(允许减量至40 mg和20 mg);克唑替尼250 mg每日两次(允许减量至200 mg每日两次和250 mg每日一次);沃利替尼600 mg/d(允许减量至400 mg和200 mg)。主要终点为无进展生存期(PFS)。在意向性治疗(ITT)人群中进行分析,未接受治疗方案的患者不纳入安全性分析。
结果:2016年4月5日至2019年12月15日期间,152例患者被随机分配到四个研究组。随机分组后,排除5例不符合资格的患者且不纳入分析,最终共有147例合格患者。在预先指定的无效性分析后,沃利替尼组(29例)和克唑替尼(28例)停止入组,而舒尼替尼组(46例)和卡博替尼组(44例)则按计划完成。卡博替尼组患者的PFS [中位:9.0个月,95% 置信区间(CI):6-12] 显著长于舒尼替尼组(中位:5.6个月,95% CI:3-7;进展或死亡的风险比为0.60,95% CI:0.37-0.97;单侧检验P=0.019)。卡博替尼组的缓解率为23% ,而舒尼替尼组为4%(双侧检验P=0.010)。与舒尼替尼相比,克唑替尼或沃利替尼治疗均未改善PFS。发生3级或4级不良事件的患者比例如下:45例接受舒尼替尼治疗的患者中有31例(69%),43例接受卡博替尼治疗的患者中有32例(74%),27例接受克唑替尼治疗的患者中有10例(37%),28例接受沃利替尼治疗的患者中有11例(39%);卡博替尼组有1例患者发生5级血栓栓塞事件。
表1 患者特征
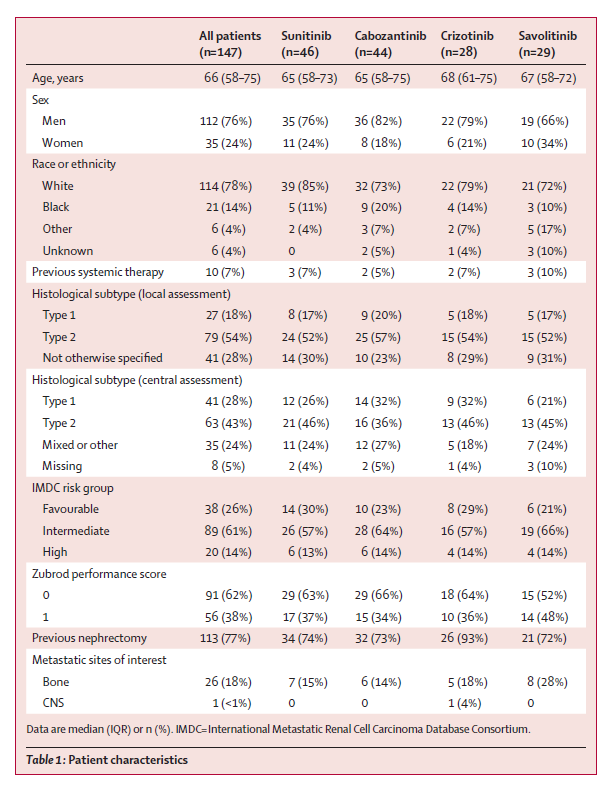

图1 Kaplan-Meier分析的PFS率(A)和总生存(OS)率(B)
MET突变在PRCC中常见,尤其在I型PRCC患者中,舒尼替尼作为上市较早的VEGF-酪氨酸激酶抑制剂(TKI),在其既往的研究中显示出治疗PRCC的有效性,客观缓解率(ORR)最高达13%,由于治疗药物较少,舒尼替尼一直是PRCC的标准治疗药物。之后上市的卡博替尼、克唑替尼和沃利替尼虽然都有各自的研究显示其在MET驱动的PRCC患者中的有效性,但目前尚没有几个药物之间的横向对比。本研究结果显示出卡博替尼作为一种VEGF和MET多靶点抑制剂,与标准治疗舒尼替尼相比显著提高了中位PFS(mPFS),此结果也与另一个VEGF、MET多靶点抑制剂Foretinib结果一致,也证实了VEGF和MET是PRCC发病的重要靶点。因本研究入组人群未检测MET突变,而沃利替尼作为MET抑制剂在该研究中表现不尽人意原因可能为该组MET突变频率低。基于PRCC患者不同分子亚型和生物标志物的研究,从而选择不同的药物治疗仍是目前临床和科研需要关注的重点。
新辅助SABR治疗肾细胞癌下腔静脉癌栓——II期试验导入期(lead-in)的安全性结果

目的:评估肾细胞癌(RCC)患者新辅助立体定向消融放疗(Neo-SABR)后接受根治性肾切除和癌栓取出术(RN-IVCT)的可行性、安全性、肿瘤学结果和免疫学改变。
方法和材料:本研究结果来自一项单臂I-II期试验的安全导入期,患有RCC和下腔静脉癌栓(IVC-TT)的患者接受Neo-SABR(40Gy/5次)治疗,随后接受开放性RN-IVCT。主要终点是RN-IVCT后90天内无4-5级不良事件(AEs)。探索性终点包括SABR引起的病理学和免疫学改变。
结果:6例患者进入最终分析。未观察到4-5级AEs。术后90天内共报告81次AEs:73%(59/81)为1级, 23%(19/81)为2级,4%(3/81) 为3级。中位随访24个月后,所有患者均存活。1例患者出现新发转移性疾病。确诊时为转移性的3例患者中,在未使用系统治疗的情况下,1例患者出现完全缓解(CR),另1例患者出现远隔部分缓解(PR)。Neo-SABR导致IVC-TT中Ki-67表达降低,PD-L1表达增加。炎性细胞因子和自身抗体滴度反映了非疾病进展的患者具有更好的机体免疫状态。
结论:Neo-SABR后进行RN-IVCT治疗RCC IVC-TT是安全可行的。尽管尚未建立与SABR的直接因果关系,良好的机体免疫环境有助于预测SABR治疗的远隔缓解和RCC无复发生存期。
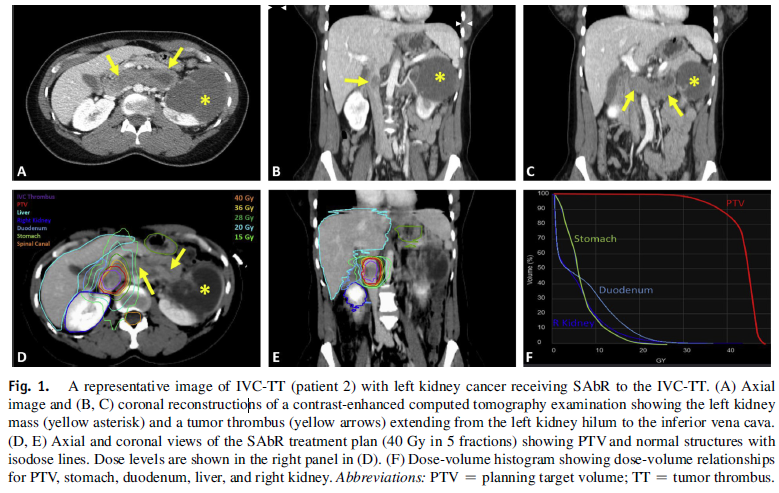
图2. 患者2接受SABR治疗IVC-TT的代表性图像
表2. 队列与肿瘤特征

表3. 不良事件

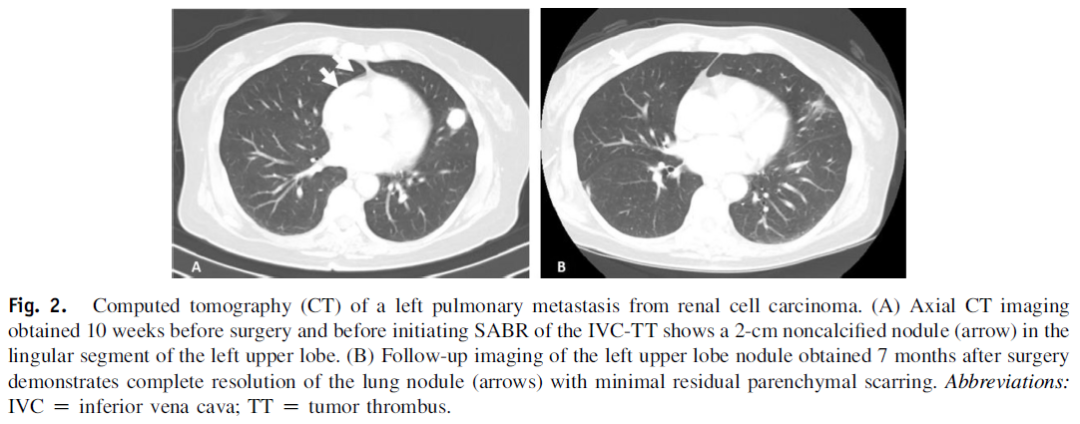
图3. RCC左肺转移的计算机断层扫描(CT):(A) 在手术前10周和开始使用SABR治疗IVC-TT之前获得的轴向CT成像显示左上叶的舌段有直径约2 cm的未钙化结节(箭头所示);(B) 术后7个月的左上叶结节随访影像显示,肺结节(箭头所示)完全消退,微小残留实质瘢痕。
图4. 自身抗原阵列:(B)自身抗体信号强度的百分比变化仅在治疗后未进展的患者中具有显著性,而在疾病进展的患者中则不显著(P =0.049)。(C) 无进展(A-C)患者的抗CA IX自身抗体血清滴度高于进展(D-F)患者(P=0.013-0.019)。
该研究是首项前瞻性评估SABR用于RCC IVC-TT的的临床试验,虽然该研究存在几处局限性,包括样本量少及缺少对照组,但结果也表明了该方法具有良好的安全性:没有发生4-5级的AEs,达到导入期主要终点, 因此II期研究也在进行中。值得注意的是Neo-SABR具有远隔缓解的效果,在3例未接受系统治疗的转移性患者中,1例肺部转移灶达到远隔完全缓解,另一例出现远隔部分缓解,因此期待该研究II期临床研究结果的公布。
立体定向放疗(SBRT)联合药物治疗转移性RCC(系统综述)

目的:对SBRT联合药物治疗在转移性RCC患者中的作用以及相关的肿瘤学结果和毒性特征,进行系统回顾和荟萃分析。
方法:根据优先报告的条目和Meta分析,从2000年1月1日至2020年4月30日对Pubmed、Medline和Embase数据库进行严格审查。为了评估所审查文献的整体质量,使用了改良的德尔菲工具。
结果:纳入6项研究,共216例患者。TKI是与SBRT联合应用最广泛的药物,在93%的患者中使用。没有放射治疗相关不良反应频率增加的报告。
结论:在联合药物使用的情况下,SBRT结果是安全的,没有增加药物相关的AEs。此外,这种方法在局部控制(LC)和总生存期(OS)方面显示出有前景的临床结果。
表4. 研究和患者特征

表5. 治疗结果和毒性

表6. SBRT特征和用药计划表

表7. 正在进行中的SBRT联合药物治疗mRCC的临床试验

转移性RCC是一种高度血管化的肿瘤,也表现出特殊的免疫原性特征,这两种特征均对治疗结局有显著影响。SBRT引起内皮损伤,释放抗原肽,并触发适应性免疫应答。TKI/IO/TKI+IO联合SBRT也是一种有效选择。SBRT在mRCC患者中的疾病控制率(DCR)与转移瘤切除术相当(寡进展患者中),多项研究已证实SBRT可改善生存结局并降低疾病进展风险,局部控制率高,可以在较大程度上延长患者生存,特别适合出现寡进展的患者。但目前尚无前瞻性研究评估SBRT对临床结局的明确影响,也有待确定适宜患者、药物与放疗的最佳整合方案,包括放疗的时机。
国际儿科肿瘤学会(SIOP) 93-01、2001和UK-IMPORT数据库中注册的儿童RCC患者的特征

摘要:儿童RCC很少见。本项研究是国际儿科肿瘤学会-肾癌研究组(SIOP-RTSG)注册的有关儿童RCC患者的首次报告。研究纳入在SIOP 93-01、2001和UK-IMPORT数据库中注册的、经组织学证实的儿童RCC患者。使用Kaplan-Meier方法分析无事件生存期(EFS)和OS。在1993年至2019年之间,共注册了122例儿童RCC患者。现有详细数据(n=111)显示56例为局限性RCC,30例为局部进展型RCC,25例为转移性RCC,无双侧RCC。根据世界卫生组织2004年的组织学分类, 在65/122例可进行TFE3和/或TFEB易位免疫组化和分子检测的患者中,最常见的组织学亚型为易位型(tRCC)(36/64,56.3%)、乳头状细胞型(19/64,29.7%)和透明细胞型(4/64,6.3%),1例患者没有报告组织学亚型。而在其余57例患者中,无法进行易位检测,或者缺少TFE细胞遗传学和/或免疫组化结果。这一组中最常见的组织学亚型为乳头状细胞型(21/47,44.7%)和透明细胞型(11/47,23.4%)。10例患者没有报告组织学亚型。整个研究组中估计的5年EFS率和OS率分别为70.5%(95% CI:61.7-80.6)和84.5%(95% CI=:77.5-92.2)。局限性、局部进展型和转移性RCC患者中估计的5年OS率分别为96.8%、92.3%和45.6%,转移性RCC患者的生存率明显较低。这项描述性研究强调了进行全面性、前瞻性TFE检测的重要性。
表8. 患者及疾病特征(n = 122)
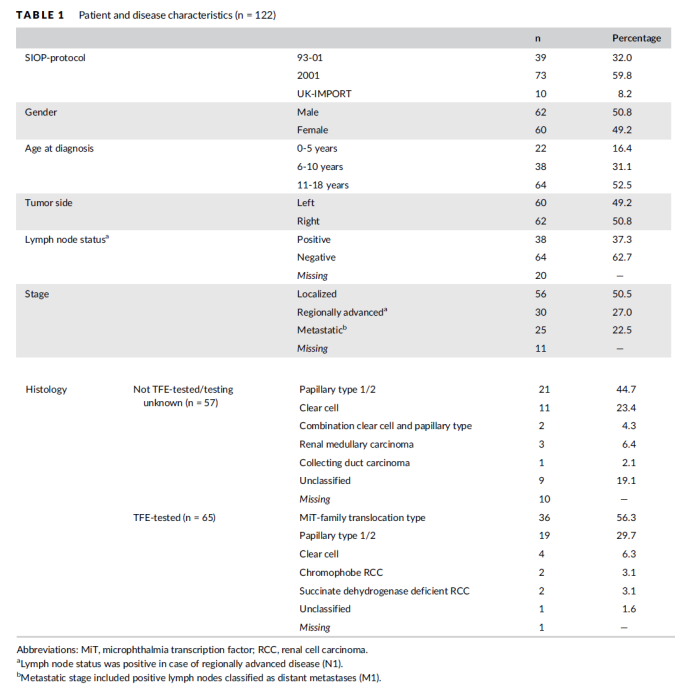
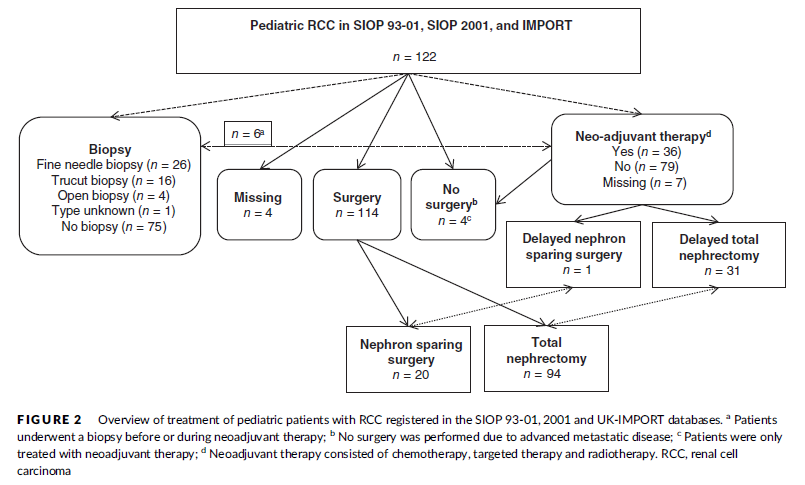
图5. 在SIOP 93-01、2001和UK-IMPORT数据库中注册的儿童RCC的治疗概况
表9. 儿童RCC中不同疾病分期的术后治疗情况(n=96)
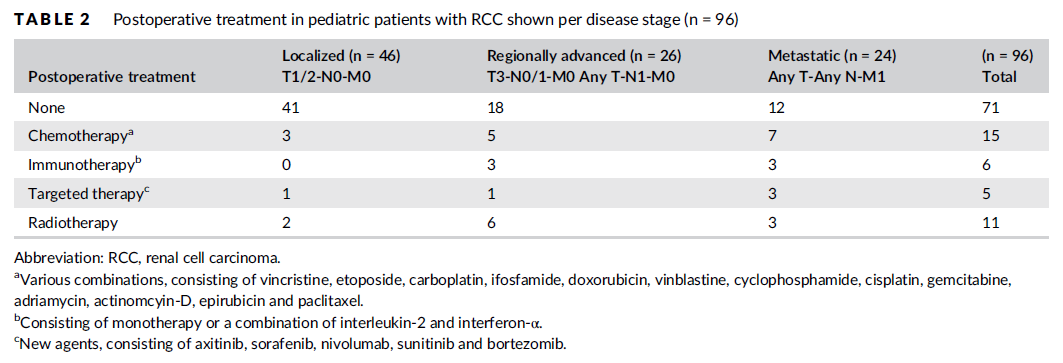
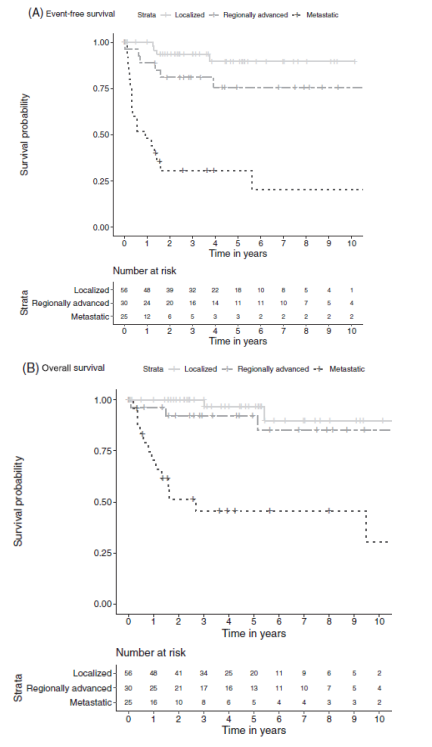
图6. 根据疾病分期,估计的EFS率(A)和OS率(B)
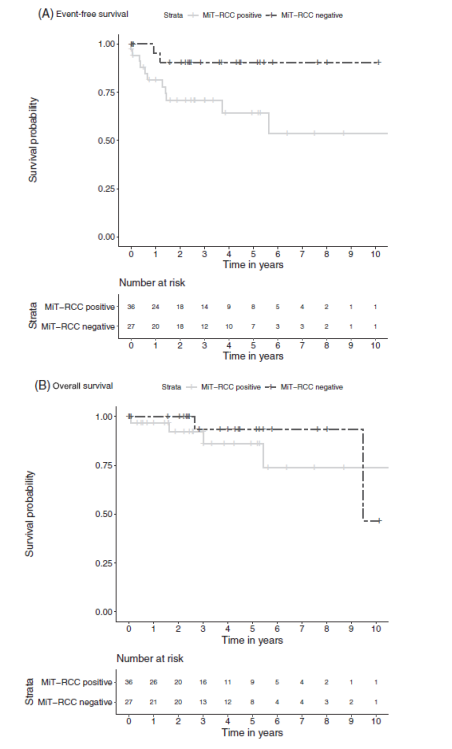
图7. TFE检测为MiT-RCC阳性和MiT-RCC阴性的患者中,估计的EFS率(A)和OS率(B)。MiT-RCC:易位型肾细胞癌。
儿童RCC是一种少见肿瘤,很少有大量报道其特征的报告。儿童RCC半数以上都是tRCC,其中XP11.2易位占比最大。成人与儿童肾癌发病机制明显不同,成人RCC更多的是以VHL通路改变导致的血管生成性肿瘤,而儿童RCC多为染色体易位改变的tRCC,不同年龄段的肾癌驱动因素有其特异性。近半数患儿表现为I/II期疾病,肾癌根治术+扩大淋巴结清扫是早期tRCC首选治疗方案。tRCC转移期表现出一定的侵袭性,但目前成人RCC标准治疗在儿童tRCC效果不佳,且目前已上市靶向药物均未纳入18岁以下受试者,转移期患者药物选择数据缺乏。对tRCC患者来源的异种移植模型RP-R07分析发现PI3K/AKT/mTOR通路富集,提示mTOR抑制剂的潜在作用,但仍需要更多的临床证据证实。
在IMmotion150研究中经阿替利珠单抗或舒尼替尼单药治疗后进展的转移性RCC患者,应用阿替利珠单抗联合贝伐珠单抗治疗的疗效和安全性:一项随机II期临床研究

背景:免疫检查点抑制剂联合抗VEGF靶向治疗作为转移性RCC的二线治疗疗效尚未进行前瞻性评估。
目的:评估经阿替利珠单抗或舒尼替尼单药治疗后进展的转移性RCC患者,使用阿替利珠单抗联合贝伐珠单抗治疗的疗效和安全性。
方法:IMmotion 150是一项多中心、随机、开放标签的II期研究,研究对象为未经治疗的转移性RCC患者。受试者随机接受阿替利珠单抗或舒尼替尼治疗,研究者根据RECIST 1.1评估疾病进展后是否可接受阿替利珠单抗联合贝伐珠单抗二线治疗,用法为每3周静脉注射阿替利珠单抗1200 mg和贝伐珠单抗15 mg/kg。二线治疗分析的终点包括ORR、PFS和安全性。
结果:阿替利珠单抗组59例和舒尼替尼组78例患者符合入组条件,其中103例患者接受二线阿替利珠单抗联合贝伐珠单抗治疗(阿替利珠单抗组,n=44;舒尼替尼组,n=59)。ORR为27%(95% CI:19-37)。从二线治疗开始后的mPFS为8.7个月(95% CI:5.6-13.7)。在25例无PFS事件的患者中,中位随访时间为19.4 个月(95% CI:12.9-21.9),86例(83%)患者发生治疗相关的AEs,31例(30%)发生3级或4级AEs。
结论:阿替利珠单抗或舒尼替尼治疗进展的转移性RCC患者使用阿替利珠单抗联合贝伐珠单抗进行二线治疗,超过四分之一的患者肿瘤缩小,且副作用可控。需要进一步研究转移性RCC的序贯策略。
表10. 患者基线特征
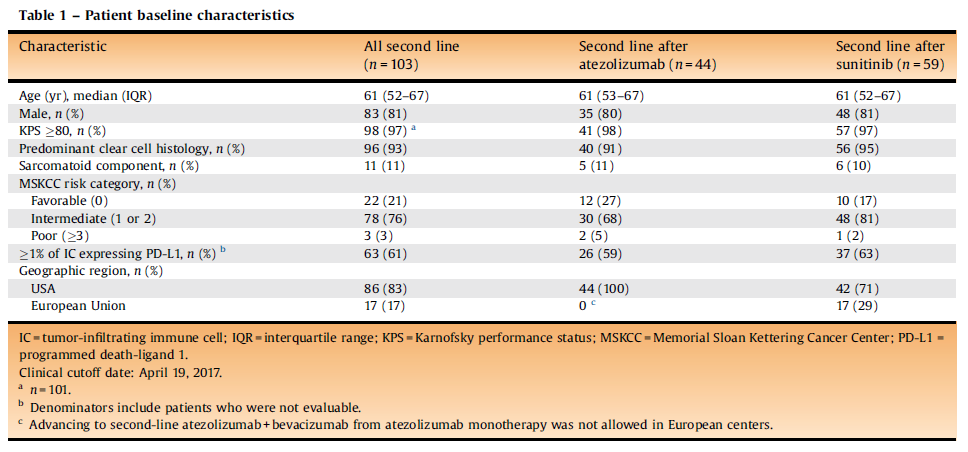
表11.在进展后接受阿替利珠单抗+贝伐珠单抗二线治疗的患者中,研究者评估的确认缓解率(RECIST 1.1)
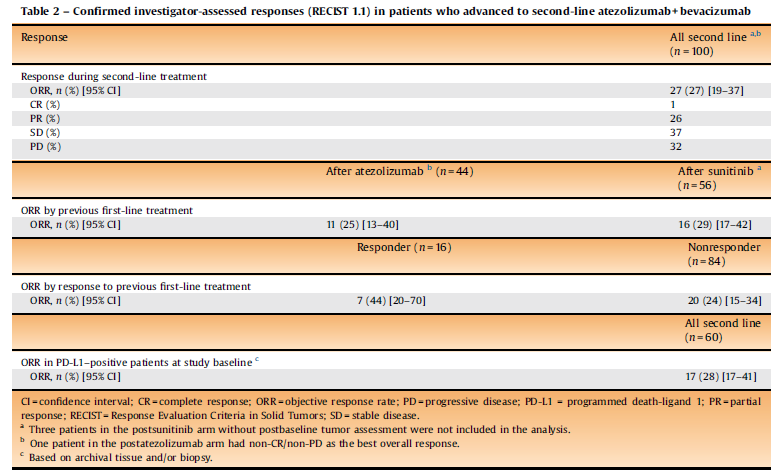
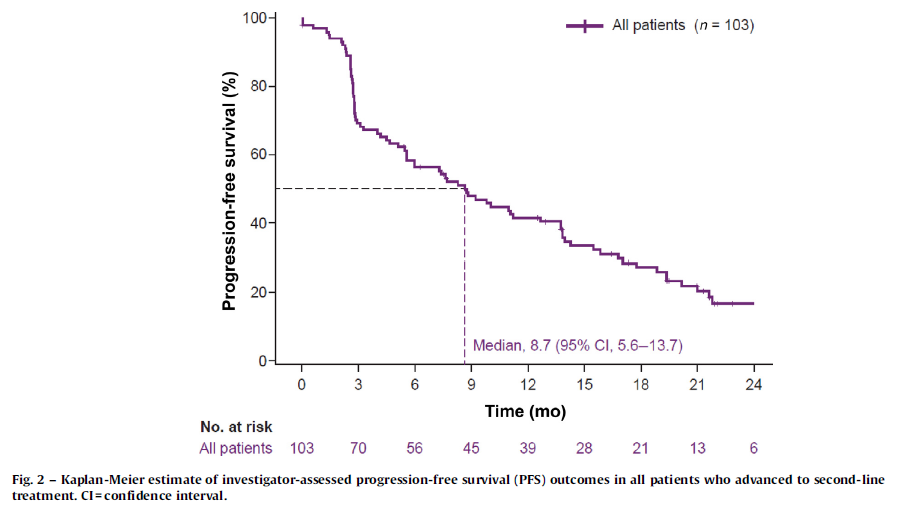
图8. 进展后接受二线治疗的所有患者中,Kaplan-Meier估计的PFS率结果
本研究探索了一线舒尼替尼或阿替利珠单抗治疗进展后,二线贝伐珠单抗联合阿替利珠单抗治疗患者的疗效及安全性。一线舒尼替尼和阿替利珠单抗组的mPFS分别为5.7个月和4.8个月,进展后予以贝伐珠单抗和阿替利珠单抗联合治疗,mPFS可达8.7个月,且安全性可控,证明靶向+免疫联合在RCC二线治疗中的疗效显著。目前RCC一线治疗较为明确,但二线乃至后线选择并无定论,晚期RCC如何进行全程管理,使患者获益最大化,是当前亟需解决的临床问题。该研究探索了转移性RCC一线单药治疗、二线联合的疗效,而该研究中还有一组队列患者接受了一线联合治疗,但文中未提及其二线治疗方案以及临床获益情况,期待后续能有该队列的结果,进一步探索联合时代RCC全程治疗方案的排兵布阵。
参考文献:
【1】Pal SK, Tangen C, Thompson IM, et al. A comparison of sunitinib with cabozantinib, crizotinib, and savolitinib for treatment of advanced papillary renal cell carcinoma: a randomised, open-label, phase 2 trial. Lancet. 2021 Feb 20;397(10275):695-703.
【2】Margulis V, Freifeld Y, Pop LM, et al. Neoadjuvant SAbR for Renal Cell Carcinoma Inferior Vena Cava Tumor Thrombus - Safety Lead-in Results of a Phase II Trial. Int J Radiat Oncol Biol Phys. 2021 Feb 4;S0360-3016(21)00163-2.
【3】Ingrosso G, Becherini C, Francolini G, et al. Stereotactic body radiotherapy (SBRT) in combination with drugs in metastatic kidney cancer: A systematic review. Ingrosso G,et al. Crit Rev Oncol Hematol. 2021 Mar;159:103242.
【4】van der Beek JN, Hol JA, Coulomb-l'Hermine A, et al. Characteristics and outcome of pediatric renal cell carcinoma patients registered in the International Society of Pediatric Oncology (SIOP) 93-01, 2001 and UK-IMPORT database: A report of the SIOP-Renal Tumor Study Group. Int J Cancer. 2021 Jan 18.
【5】Powles T, Atkins MB, Escudier B, et al. Efficacy and Safety of Atezolizumab Plus Bevacizumab Following Disease Progression on Atezolizumab or Sunitinib Monotherapy in Patients with Metastatic Renal Cell Carcinoma in IMmotion150: A Randomized Phase 2 Clinical Trial. Eur Urol. 2021 Mar 4;S0302-2838(21)00003-8.

MCC号VOR21033469有效期2022-03-27,资料过期,视同作废。
本文旨在传递医学前沿信息和研究进展,文中所涉及的部分药物尚未在中国获批适应症,相关数据仅供临床医生参考,非商业用途,请自觉保护作品著作权;本资料中引用的公开发表文献仅代表作者的个人观点。



 个人中心
个人中心
 我是园区
我是园区




