您还不是认证园区!
赶快前去认证园区吧!

2020年1-7月,FDA共批准32个新药上市,7月批准7个。
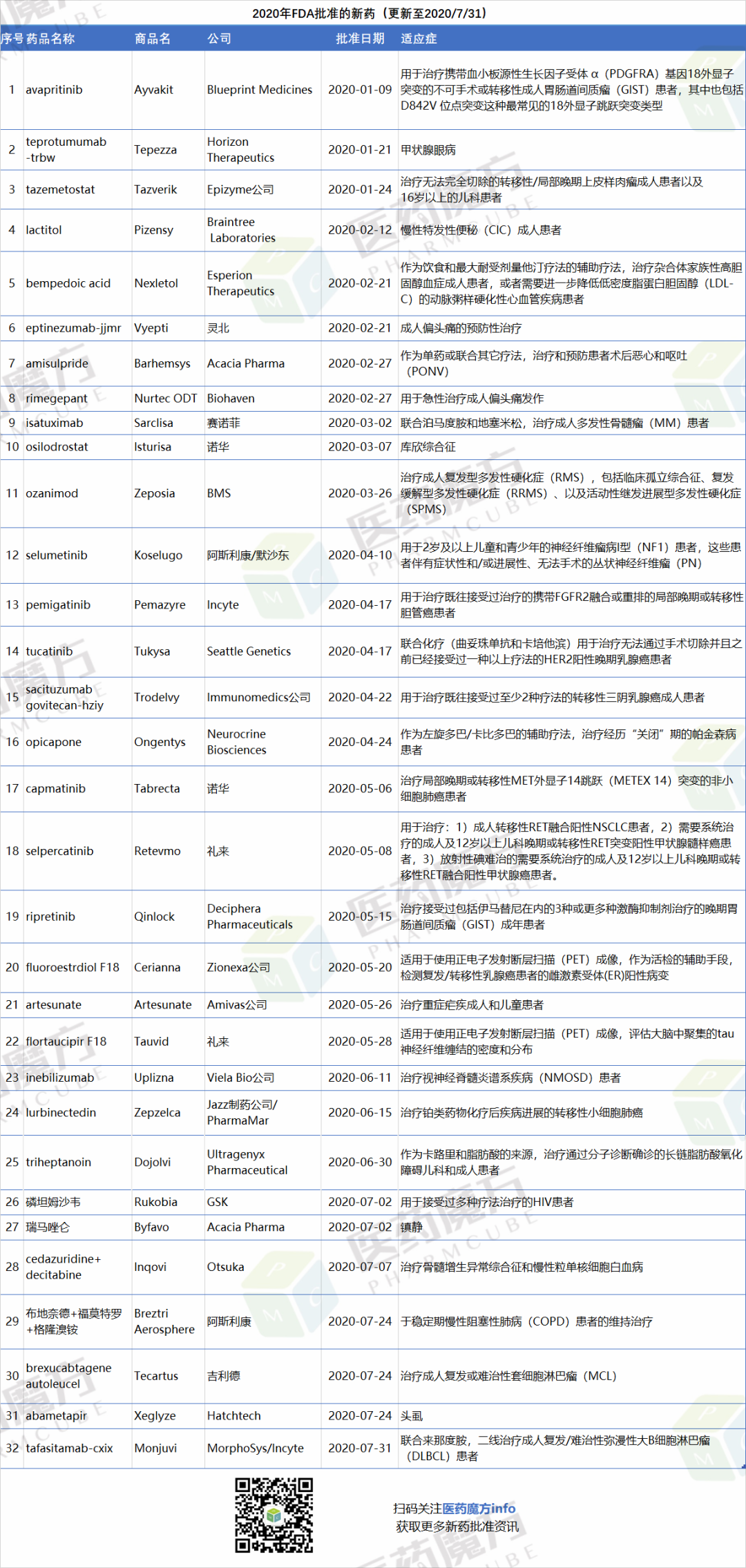
注:此处所列新药,主要指FDA批准的新分子实体、新生物制品、细胞疗法、基因疗法,不包括疫苗。
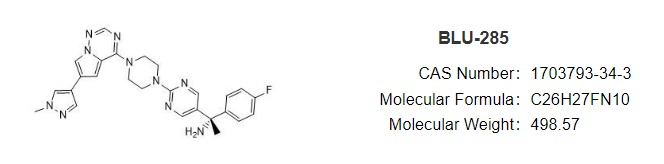
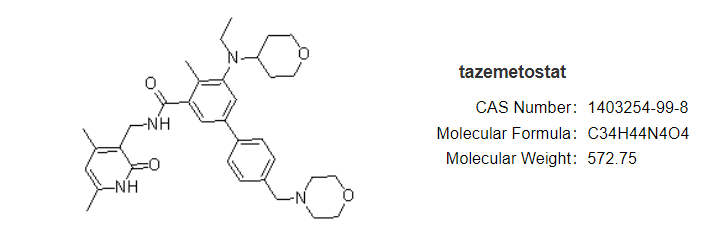
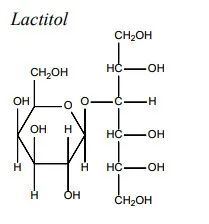
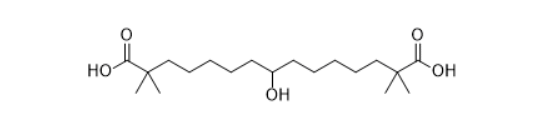
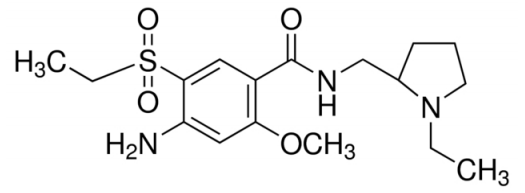
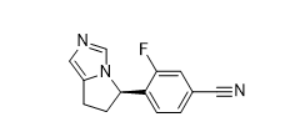
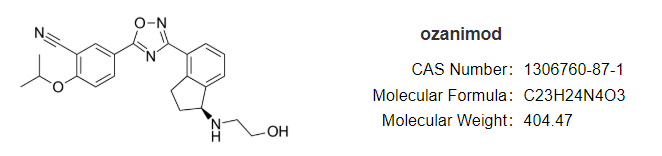

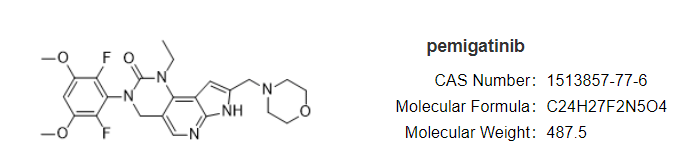
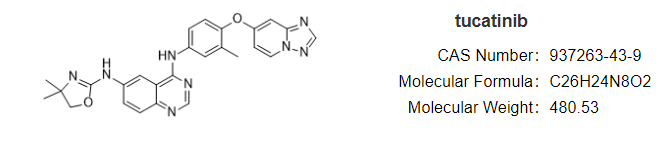
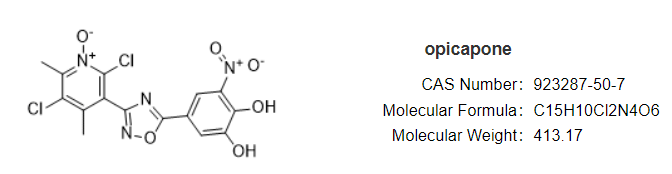
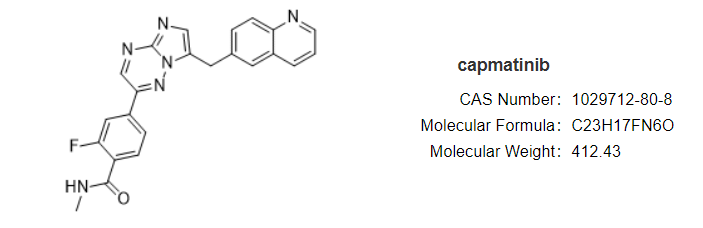
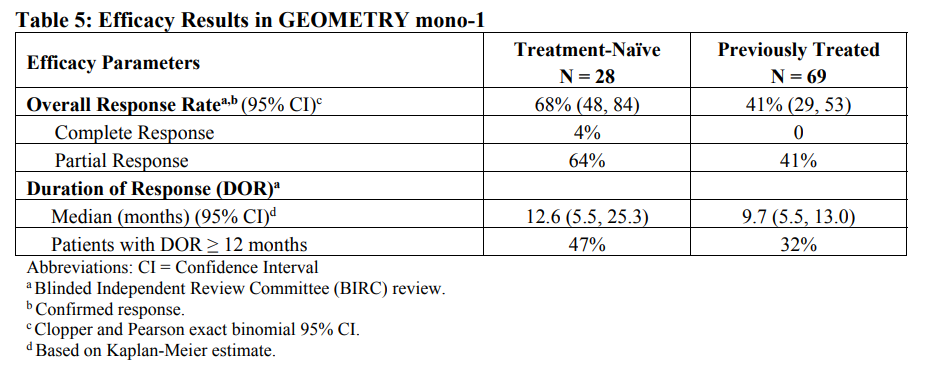
安全性方面,capmatinib最常见的不良反应为周围水肿(42%)、恶心(33%)、肌酐升高(20%)、呕吐( 19%)、疲劳(14%)、食欲下降(13%)和腹泻(11%)。大部分AE等级为1/2级。
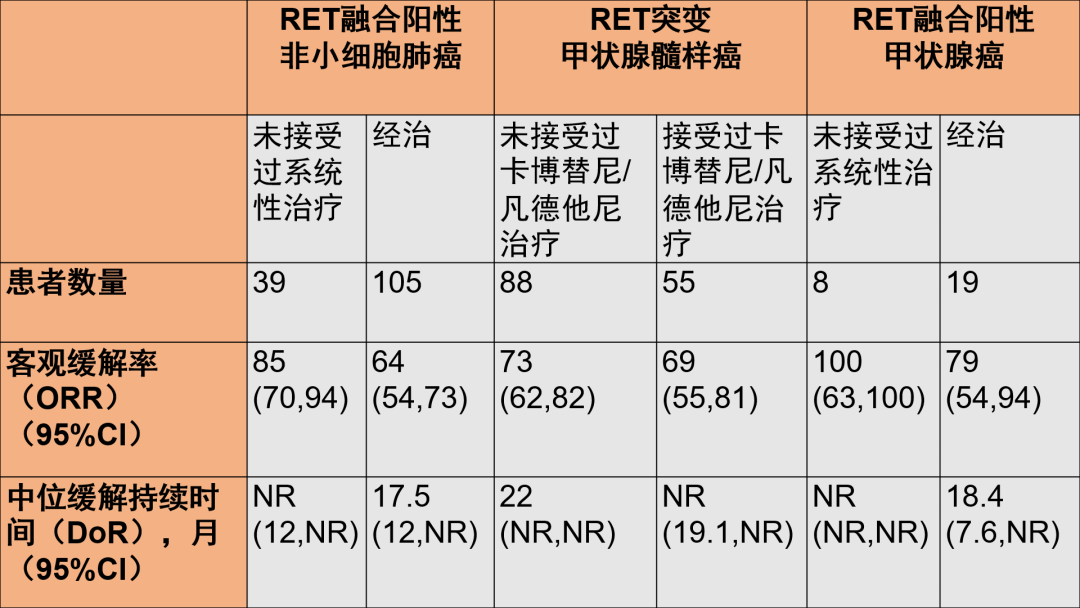
6月11日,FDA批准Viela Bio公司的CD19单抗Uplizna(inebilizumab)上市,用于治疗AQP4阳性的成人视神经脊髓炎谱系疾病(NMOSD)患者。豪森药业曾于2019/5/28与Viela Bio公司达成协议,斥资2.2亿美元获得了该药中国权益。
NMOSD是一种罕见自身免疫疾病,患者体内过度活跃的免疫细胞和自身抗体会攻击视神经和脊髓,导致患者会出现失明、截瘫、感觉丧失、膀胱失调、以及外周疼痛等症状。据估计,80%的NMOSD患者AQP4抗体呈阳性。inebilizumab可以结合B细胞表面的CD19抗原,耗竭CD19+B细胞。
7月7日,FDA批准Otsuka的Inq ovi(cedazuridine+地西他滨)上市,用于治疗骨髓增生异常综合征和慢性粒单核细胞白血病。这是FDA批准的首个口服去甲基化制剂。
7月24日,FDA批准Hatchtech公司的Xeglyze(abametapir)乳液上市,用于局部治疗6个月及以上的头虱。
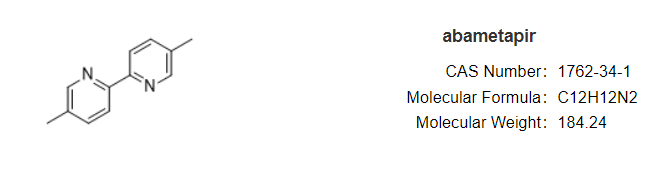





 个人中心
个人中心
 我是园区
我是园区




