
由于AD患者数量不断增加以及该疾病带来的公共卫生危机日益严重,迫切需要治疗来预防、延迟发病、减缓进展并改善AD症状。尽管顶着近20年来首个被FDA批准上市的“神药”光环,但渤健(Biogen)阿尔茨海默症(AD)治疗药物Aduhelm (aducanumab) 自上市以来却是一波三折,争议不断。Aducanumab是一种抗淀粉样蛋白单克隆抗体,另外两种单克隆抗体(donanemab和lecanemab)正在接受美国食品药品监督管理局(FDA)的审查。
截止2022年1月25日,共在172项AD治疗试验中确定了143种相关药物。其中,47项III期试验中有31种药物;94项II期试验中有82种药物;31项I期试验中有30种药物。图1显示了目前正在进行AD临床试验的所有药物化合物(生物制剂和小分子)。正在研究的最常见药物是DMT(119种药物;占试验中药物总数的83.2%);24种(16.8%)为对症药物,包括14种(占试验中所有药物的9.8%)靶向认知增强药物和10种(占试验中所有药物的6.9%)旨在治疗神经精神和行为症状的药物。在DMT中,40个(33.6%的DMT)是生物制剂,79个(66.4%的DMT)是小分子。20种(16.8%)DMTs分别以淀粉样蛋白、13例(10.9%)tau、23例(19.3%)炎症、19例(16%)突触可塑性/神经保护为其主要机制靶点。

图1.2021年阿尔茨海默病治疗临床试验中的药物
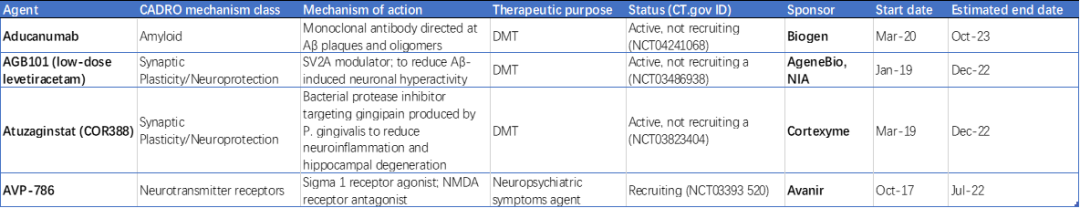
47项III期临床试验中共有31种药物(图1和2,表1)。III期试验中的21种(67.8%)药物为DMT,包括5种(16.1%)生物制剂和16种(51.6%)小分子。有5种(16.1%)推定的认知增强剂和5种(16.1%)靶向行为症状的药物。III期DMT中代表的CADRO机制包括淀粉样蛋白(6种药物;28.6%的DMT);突触可塑性/神经保护(4;19%);氧化应激(3;14.3%);代谢和生物能量学(3;14.3%);tau蛋白(1;4.8%);炎症(1;4.8%);蛋白质稳态/蛋白质病(1;4.8%);脉管系统(1;4.8%);和肠-脑轴(1;4.8%)。图2显示了III期研究中基于CADRO的药物MOA。其中13种(42%)是已获批用于其他适应症的经再利用治疗(8 = DMT;2 = 认知增强剂;3 = 治疗神经精神症状)。在过去一年(2021年),已完成或终止了4项试验。
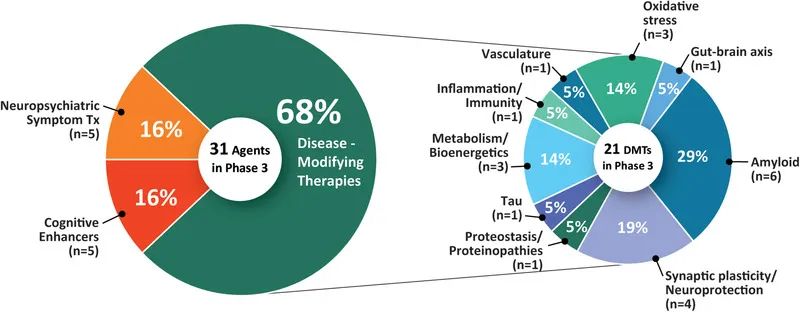
图2.III期研究中药物的作用机制
III期试验每个试验平均纳入791例受试者,所有目前正在进行的III期试验共需要37,184例受试者。DMT预防试验平均纳入1058例受试者,平均持续时间为362周。关注前驱AD或前驱AD/轻度AD痴呆的DMT试验平均有991例受试者,平均持续时间为243周。招募轻度至中度AD痴呆受试者的DMT试验平均包括776例受试者,平均持续时间为162周。
预防试验的平均治疗暴露时间为159周,前驱AD或前驱AD/轻度AD痴呆试验的平均治疗暴露时间为105周,轻度至中度AD痴呆试验的平均治疗暴露时间为48周。
认知增强剂试验的平均持续时间为167周,包括24个治疗周,计划招募平均392名参与者。神经精神症状治疗试验的平均持续时间为218周,包括18周治疗,平均纳入478例受试者。
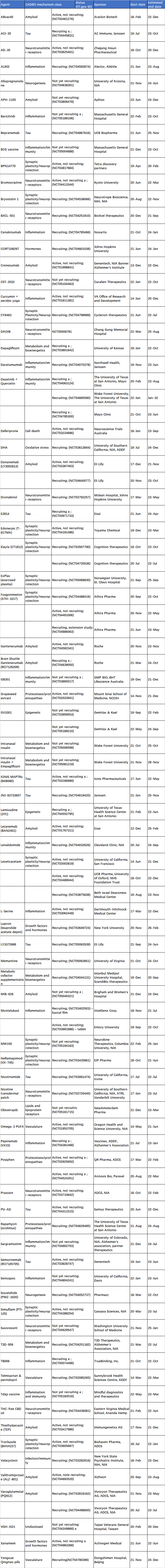
94项II期试验共有82种药物(图1和3,表2)。II期试验中71种(86.6%)药物为DMT,包括26种生物制剂和45种小分子。有7种推定的认知增强剂和4种靶向行为症状的药物。II期DMT治疗中代表的CADRO机制包括炎症(17种药物);突触可塑性/神经保护(12);淀粉样蛋白(11);tau蛋白(9);代谢和生物能量学(4);神经递质受体(3);蛋白质稳态/蛋白质病(3);脉管系统(3);神经发育(2);生长因子和激素(2);表观遗传调节因子(2);ApoE、脂质和脂蛋白受体(1);氧化应激(1);和细胞死亡(1)。图3显示了II期研究中基于CADRO的药物作用机制。在过去一年(2021年),已完成或终止了23项II期试验。
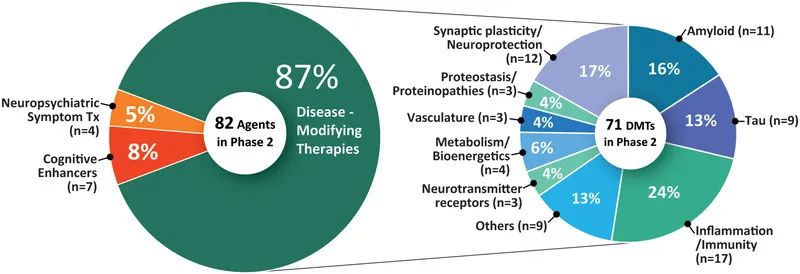
图2.II期研究中药物的作用机制
表2. 阿尔茨海默病药物开发II期药物(clinicaltrials.gov访问日期:2022年1月25日)
II期试验平均每项试验纳入127例受试者,所有目前正在进行的ii期试验共需要11,938例受试者。DMT预防试验平均纳入151例受试者,平均持续时间为284周。关注前驱AD或前驱AD/轻度AD痴呆的DMT试验平均有138例受试者,平均持续时间为198周。招募轻度至中度AD痴呆受试者的DMT试验平均包括107例受试者,平均持续时间为172周。
预防试验的平均治疗暴露时间为97周,前驱AD或前驱AD/轻度AD痴呆试验的平均治疗暴露时间为53周,轻度至中度AD痴呆试验的平均治疗暴露时间为31周。DMT试验的招募期为预防(145周)、前驱AD和前驱AD/轻度AD痴呆(117周)以及轻度至中度AD痴呆(118周)。
II期认知增强剂试验的平均持续时间为127周,包括27个治疗周,平均纳入105例受试者。治疗神经精神症状的II期试验的平均持续时间为150周,包括8周治疗,平均纳入122例受试者。
31项I期试验中有30种药物(图1,表4)。I期试验中有27个DMT,包括9个生物制剂和18个小分子。I期DMT治疗中代表的CADRO机制包括炎症(5种药物);表观遗传调节因子(4种);淀粉样蛋白(3种);tau蛋白(3种);蛋白质稳态/蛋白质病(3种);突触可塑性/神经保护(3种);神经发育(2种);脉管系统(2种);细胞死亡(1种);和代谢和生物能量学(1种)。
在31项III期DMT试验中,6项试验(19%)使用淀粉样蛋白正电子发射断层扫描(PET)作为入选标准,6项试验(19%)使用淀粉样蛋白PET或脑脊液(CSF)淀粉样蛋白指标。5项(16%)III期DMT试验使用CSF‐淀粉样蛋白/tau比值或淀粉样蛋白PET作为入选标准,1项试验使用血浆磷酸化tau蛋白(p‐tau)。13项(42%)III期DMT试验未使用生物标志物作为研究入选标准。一项认知增强剂的III期试验使用CSF淀粉样蛋白或CSF tau蛋白进入研究。
在II期研究中,12项(14%)DMT试验使用淀粉样蛋白PET作为入选标准,5项(6%)使用CSF淀粉样蛋白或淀粉样蛋白比值,12项(14%)使用淀粉样蛋白PET或CSF淀粉样蛋白评估。6项(7%)II期DMT试验使用CSF-淀粉样蛋白/tau蛋白比值作为入选标准,4项(5%)使用CSF-淀粉样蛋白/tau蛋白比值或淀粉样蛋白PET,3项(4%)使用tau PET,1项试验(1%)使用淀粉样蛋白PET或CSF-tau。39项II期试验(47%)在研究入组时不需要基于生物标志物的诊断确认。
在III期DMT试验中,19项(61%)使用生物标志物作为支持性结局。10例(32%)使用淀粉样蛋白PET,7例(23%)使用tau PET支持临床结局。在II期研究中,46项DMT试验(55%)将生物标志物作为支持性结局(11项淀粉样蛋白PET;10项tau PET)。
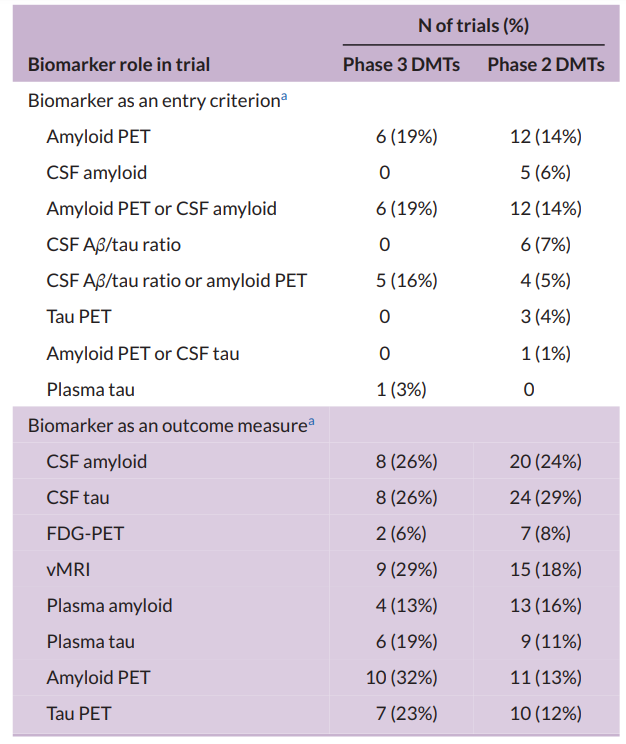
表4. 在II期和III期DMT试验中作为结局指标或入选标准的生物标记物(clinicaltrials.gov访问日期:2025年1月25日)
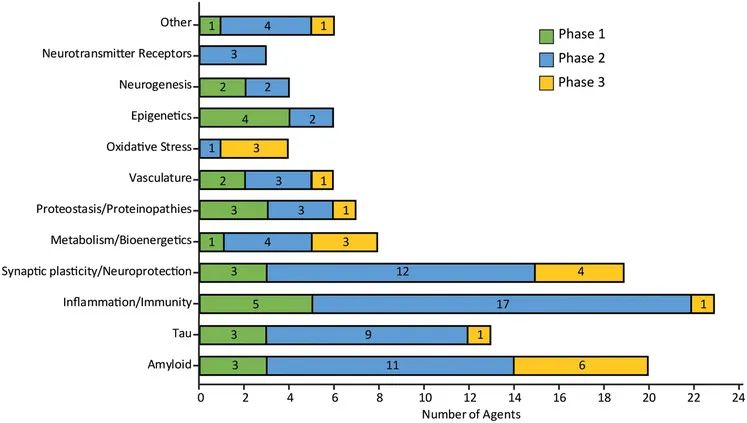
图4.不同临床试验药物靶点分析
小编总结
AD临床试验针对一系列稳健的生物学过程,包括CADRO分类中确定的大多数生物学过程。随着单克隆抗体aducanumab的获批,其他淀粉样蛋白以及tau蛋白异常、炎症和突触功能障碍的治疗在AD药物开发管线中也取得了一定进展。尽管目前大流行带来了挑战,但临床试验的数量有所增加。生物标志物越来越多地用于临床试验,包括其在诊断和结局中的应用。靶标识别、药物发现和临床试验方法的进展增加了人们对AD药物开发管线将出现更多和更好治疗的信心。
参考文献:
Cummings J, Lee G, Nahed P, et al. Alzheimer's disease drug development pipeline: 2022. Alzheimers Dement (N Y). 2022;8(1):e12295. Published 2022 May 4. doi:10.1002/trc2.12295




 个人中心
个人中心
 我是园区
我是园区





