
7 月 22 日,据 CDE 官网显示,智核生物重组人促甲状腺素注射液(SNA001) 的生物制品许可申请(BLA)已获 CDE 受理,拟用于「无远处转移分化型甲状腺癌患者在甲状腺全切或近全切术后碘 [131I] 清除残余甲状腺组织的治疗」。
来自:CDE 官网
SNA001 有望成为国内首个上市的重组人促甲状腺素(rhTSH),打破此药物在中国大陆地区空白二十余年的状态;同时也是智核生物在中国第一次递交 BLA,意味着该公司作为创新核药 Biotech 公司在商业化进程中向前迈出了重要一步。
SNA001 由智核生物自主研发,其主要成分为重组人促甲状腺激素(rhTSH),是一种与天然人促甲状腺激素 (TSH) 相同的蛋白质。早期临床试验研究显示,该药物安全耐受性良好,与原研药物 Thyrogen(赛诺菲)PK 参数高度一致(Front Endocrinol. 2021 Feb 17)。
2019 年 12 月起,在全国 16 家研究中心开展 III 期临床试验,累计纳入受试者 307 例。结果显示其疗效非劣效于目前临床实践中常用且唯一的 THW 方法,且安全耐受性良好,具有明确的临床需求和价值。此外,SNA001 采用预充针剂型,工艺稳定,更易于临床操作。
据全国肿瘤登记中心的数据显示,我国每年新发甲状腺癌病人约 22 万人,并以每年 20% 的速度持续增长。分化型甲状腺癌(DTC) 占所有甲癌病例数的 95% 以上,虽总体死亡率较低,但仍处于增长态势。手术切除+TSH 抑制治疗+131I 治疗是目前国际公认的分化型甲状腺癌治疗的金标准,2020 年接受 131I 治疗的 DTC 患者为 8.4 万人次,预计 2022 年将达到 11 万人次。
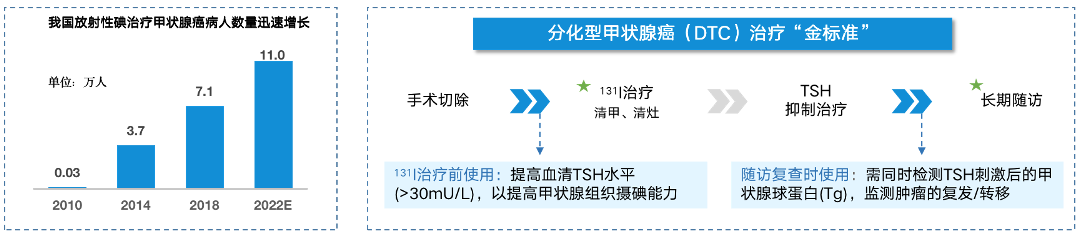
131I 治疗或随访复查前,均需要将病人血清 TSH 水平升高至 30mU/L 以上。提升 TSH 的方法有 2 种:一是传统的甲状腺激素撤退(THW),即停服甲状腺素 3-4 周,以提高内源性 TSH 的分泌;二是给予外源性 TSH,即肌肉注射 rhTSH。国内外多个指南强力推荐使用 rhTSH 作为停用甲状腺素的取代疗法,如《欧洲甲状腺学会(ETA)共识(2022 版)》、中国肿瘤临床诊疗指南《甲状腺癌诊疗指南 (2022 版)》等。
与 THW 方式相比,使用 SNA001 能够安全、快速提升血清 TSH 水平,仅需 1-2 天即可达到治疗要求,缩短治疗等待时间,还能够满足特殊患者的需求:即使停服甲状腺素后,体内 TSH 水平仍达不到治疗要求的患者。此外,选择 rhTSH 方式不需要停服甲状腺素,不会引起甲状腺功能减退如体重增加、畏寒、抑郁等不适症状,提高患者生活质量,最大程度的降低疾病复发的风险。
中国核学会核医学分会理事长、中华医学会核医学分会前任主任委员李亚明教授强调:「原研的 rhTSH 已在国外上市二十多年,造福广大的国外患者,而国内一直没有同类药物上市,很多 DTC 患者在 131I 治疗前只能选择 THW 方式,需要承受甲减的痛苦。智核生物正是从人文关怀角度让患者受益,极大减轻了部分不能耐受甲减患者的痛苦,充分体现了药物的价值。我们对 SNA001 充满期待,希望药物早日上市,造福国内的患者。」
智核生物创始人须涛博士表示:SNA001 作为国内首个申报 BLA 的 rhTSH,是以临床价值为导向、真正解决患者迫切需求的药物,我们期望药物能尽早获批,让更多的 DTC 患者拥有更好的诊疗方案。与此同时,我们自主研发的 SNA002(68 Ga 标记 PD-L1 放射性显影剂)也已获得中美 IND 批准,接下来智核生物会全力加速,更早的为广大的肿瘤患者提供更加精准的核医学诊疗药物。
点击以下卡片进入 Insight 小程序
查看「SNA001 」开发进度



免责声明:本文仅作消息分享,并不构成投资建议,也不代表 Insight 数据库的立场,文章观点仅供分享行业见解,请广大投资者谨慎。
编辑:Hebe
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn

点击阅读原文
免费试用 Insight 数据库



 个人中心
个人中心
 我是园区
我是园区




