 小分子药物潜在的重磅研发利器PROTAC(蛋白降解靶向嵌合体)技术与免疫检查点抑制剂,似乎是两条平行的轨道,不会有相交的可能。但近年来的基础机制研究中发现,免疫检查点在细胞内可以被泛素化并分类到蛋白酶体或溶酶体中进行降解。
小分子药物潜在的重磅研发利器PROTAC(蛋白降解靶向嵌合体)技术与免疫检查点抑制剂,似乎是两条平行的轨道,不会有相交的可能。但近年来的基础机制研究中发现,免疫检查点在细胞内可以被泛素化并分类到蛋白酶体或溶酶体中进行降解。
如若以PROTAC技术来定向降解肿瘤细胞表面的PD-L1,能否带来肿瘤治疗的新突破呢?
 小分子药物潜在的重磅研发利器PROTAC(蛋白降解靶向嵌合体)技术与免疫检查点抑制剂,似乎是两条平行的轨道,不会有相交的可能。但近年来的基础机制研究中发现,免疫检查点在细胞内可以被泛素化并分类到蛋白酶体或溶酶体中进行降解。
小分子药物潜在的重磅研发利器PROTAC(蛋白降解靶向嵌合体)技术与免疫检查点抑制剂,似乎是两条平行的轨道,不会有相交的可能。但近年来的基础机制研究中发现,免疫检查点在细胞内可以被泛素化并分类到蛋白酶体或溶酶体中进行降解。
如若以PROTAC技术来定向降解肿瘤细胞表面的PD-L1,能否带来肿瘤治疗的新突破呢?

PROTAC技术简介
在介绍该领域的可能性之前,我们再来回顾下PROTAC技术及免疫检查点的基本概念。
泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解。简单来说,这个过程就像是细胞将不用的文件(异常蛋白质)交给秘书(E3酶)盖上作废章(泛素化),扔到碎纸机里(蛋白酶体)。UPS是细胞内一系列生命进程的重要调节方式,与疾病的发生发展关系密切。三位杰出的科学家也因为有关泛素的研究而获得了2004年诺贝尔化学奖。

图1. 2004年诺贝尔化学奖得主
而所谓的PROTAC,全称为靶向诱导蛋白降解联合体(Proteolysis Targeting Chimeras),说白了,如下图所示,PROTAC能够与目标靶蛋白(POI)和E3连接酶结合形成三元复合物。在体内可以将靶蛋白和E3酶拉近,使靶蛋白被打上泛素标签,然后通过泛素—蛋白酶体途径降解。

图2. PROTAC技术
理论上来说,使用催化量的药物,就可以降解细胞内80%以上的蛋白质,从而使靶点从“不可成药性”变成“可成药性”属性。因此,PROTAC技术在克服耐药和靶向不可成药靶点方面潜力巨大。
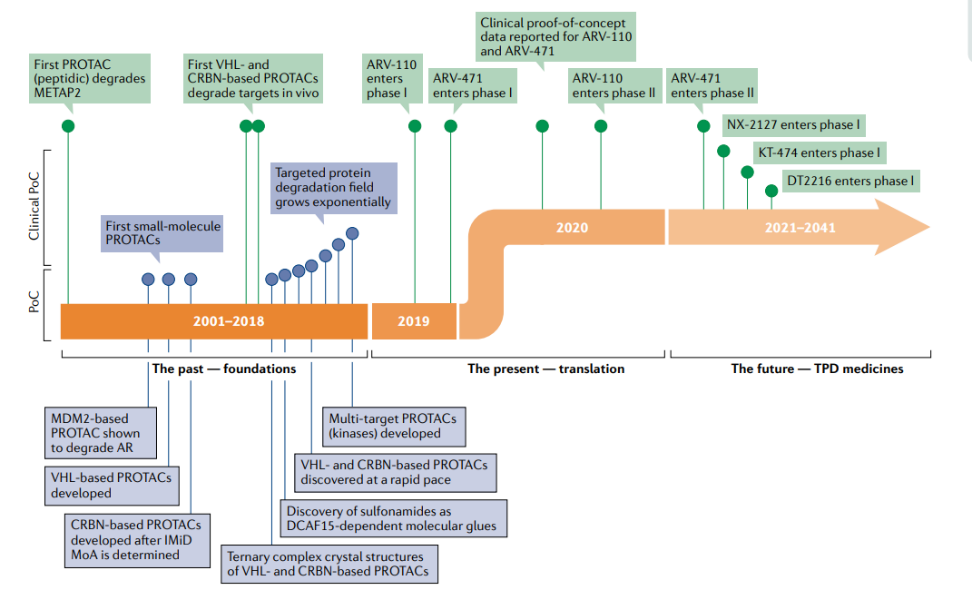
图3. PROTAC发展时间轴
也正是看到了前景可期,不仅辉瑞、诺华、罗氏、葛兰素史克、默沙东、礼来等全球制药巨头纷纷入局,更是有Arvinas、C4 therapeutics、Cellida等Biotech公司不断涌现,国内企业也奋勇向前,海思科、开拓药业、恒瑞医药、丽珠集团等也纷纷开始布局PROTAC领域。

图4. 2018年诺贝尔生理学或医学奖
而同样获得诺贝尔奖表彰的免疫检查点抑制剂,已经改写了诸多癌种的标准治疗方案,使免疫治疗成为继手术、放疗、化疗、靶向之后,肿瘤治疗的又一个得力手段。但免疫检查点抑制剂整体患者有效率在10-30%左右,且单药治疗效果有限,免疫联合其他治疗手段及多抗药物的研发成为弥补患者受益人群数量低、治疗效果有限的方向之一。同时,也有不少研究者将目光重新聚焦到小分子药物领域,期冀通过免疫检查点通路,激活免疫细胞,发挥更强大的抗肿瘤效果。PROTAC技术正是其中最具潜力的方向之一,这与体内的免疫检查点的泛素化是密切相关的。正式讲解两项诺奖级成果相交之前,我们再回顾下免疫检查点的一些基本概念。

免疫检查点的细胞表面表达过程
肿瘤微环境主要的一个特点就是相关细胞表面免疫检查点(PD-1、PD-L1、CTLA-4等)的分泌量明显升高,进一步限制免疫功能正常化的恢复。
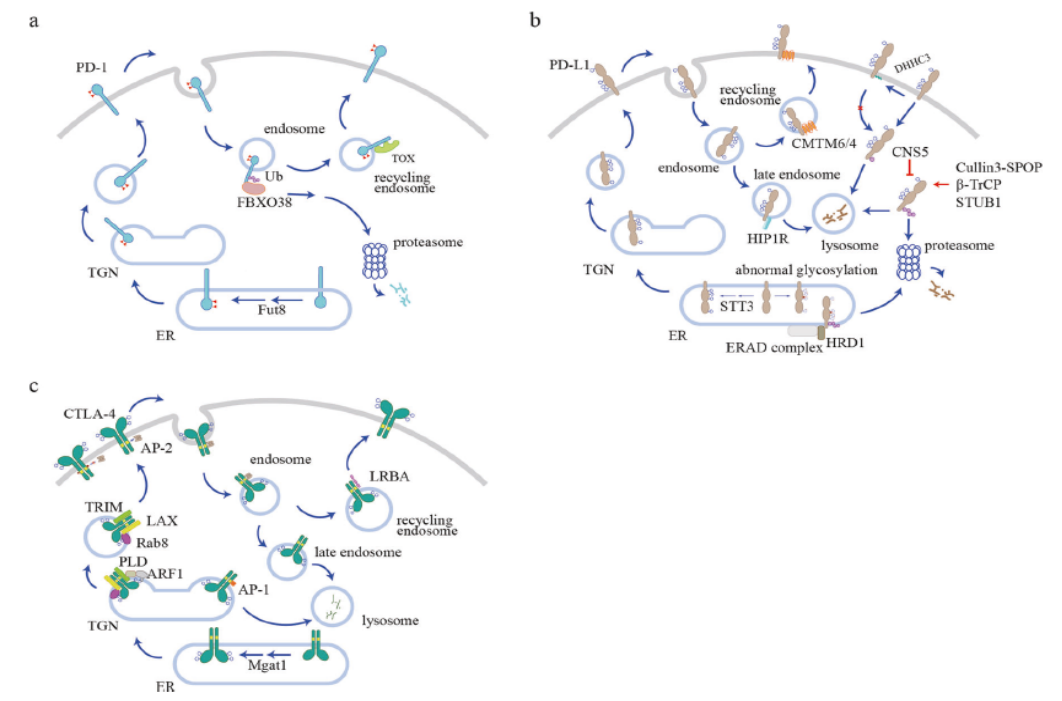
图5. 细胞膜表面PD-1、PD-L1和CTLA-4的调节
而免疫检查点的表达量并非是固定的,在细胞质及细胞膜之间是一直处于动态调整过程的。
免疫检查点通常在内质网(ER)中表达,并经过蛋白质分选系统依次通过高尔基体和分泌囊泡进行运输,然后被运送到细胞表面发挥其抑制功能。在表面传递过程中,糖基化发挥着关键性作用,以确保只有成熟和功能性免疫检查点传递到细胞表面。在到达细胞表面后,免疫检查点将受到内化和再循环的影响,这提供了一种快速调节其表面表达水平的途径。泛素化介导的蛋白质降解是控制蛋白质水平的另一个重要机制,免疫检查点可以泛素化并分类到蛋白酶体或溶酶体进行降解。这些细胞过程共同决定免疫检查点的表面水平,以形成细胞信号。
正如你所能预想的,既然免疫检查点可以泛素化并分类到蛋白酶体或溶酶体进行降解。那如果设计出合适的PROTAC分子,在肿瘤细胞内,更高效率地将泛素连接酶E3定位到PD-L1蛋白上,进而促进PD-L1蛋白在肿瘤细胞内的降解,就可以有效减少肿瘤细胞膜上PD-L1的表达量,从而减少T细胞膜上PD-1结合的可能性,是一种非常有前景的提升免疫治疗效果的方式。
接下来,我们简要展示下该领域取得的初步进展。

利用PROTAC技术降解PD-L1
许多疾病的发生和发展均与蛋白质的异常表达或聚集有关。传统小分子蛋白抑制剂的研发思路在于尽可能合成出更有效结合靶蛋白活性作用位点的化合物,通过占位功能,抑制靶蛋白的功能活性的表达,进而产生与靶蛋白相关的疾病治疗的活性。
相较于小分子化合物必须有明确靶标蛋白的结合位点,虽然PROTAC技术无需明确的靶蛋白的结合位点,通过泛素化-蛋白酶系统,直接识别靶蛋白即可完成靶蛋白的定向清除,这使得许多不具有活性结合域的蛋白质或具有不易结合位点的蛋白质成为“可成药”的靶点,将使许多疾病的药物治疗成为可能。
但是目前常用的PROTAC技术只能降解胞内蛋白,对无法定位的膜蛋白和胞外蛋白却无能为力,而大约70% FDA批准的药物都是针对膜蛋白编码基因的,如若无法有效的实现膜蛋白的定位,将大大限制PROTAC技术在蛋白质降解领域的应用。
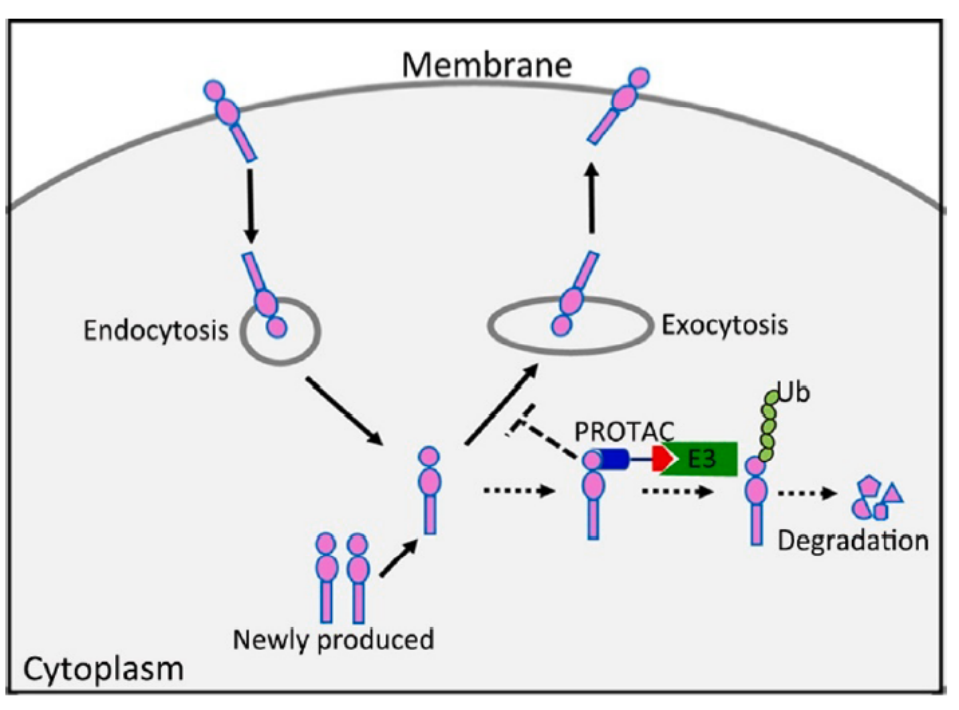
图6. PD-L1的细胞更新和通过PROTAC分子的PD-L1定向降解
以我们本次重点讨论的靶标受体PD-L1为例,作为一种跨膜蛋白,只有少数有希望的配体与PD-L1的细胞内结构域结合。且PD-L1在细胞内的表达是动态调整的过程,细胞质PD-L1有两个来源:新产生的和通过内吞作用从细胞膜“回收”的。基于这些事实,可以根据配体结合胞外区来合成和筛选PROTAC分子。希望所选的PROTAC分子能够诱导细胞质中新产生的或“循环”的PD-L1蛋白的降解,这也可能阻止PD-L1蛋白向细胞膜的转运。综上所述,这种PROTAC分子可能导致PD-L1蛋白水平的显著降低,不仅在总量上降低,而且在细胞膜上也能实现降低(上图所示)。而且,基础研究发现,PD-L1受不同E3泛素连接酶的调节,包括但不限于β-TRCP、SPOP、HRD1和STUB1(下图A),且针对PD-L1靶点的单抗类药物已经在临床得到应用。
如果设计成双特异性IgG抗体,能够有效定位两种蛋白质,例如:PD-L1和泛素连接酶E3,则能够有效解决PROTAC技术的膜蛋白定位问题,进而对PD-L1进行降解,达到我们的最终免疫增强的目的。
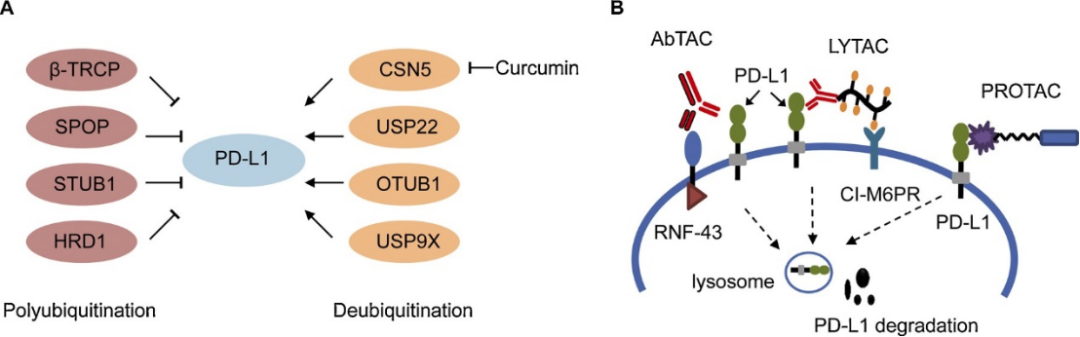
图7. 通过多泛素化、去泛素化和PROTACs调节PD-L1
2021年JACS期刊上发表了一项基于双抗体的PROTAC分子(antibody-based PROTACs, AbTACs)的研究结果,AbTACs通过同时靶向位于细胞膜上的E3连接酶(RNF43)和PD-L1,实现了PD-L1的溶酶体降解。

图8. ABTAC招募RNF43使细胞表面蛋白质内化
基于此,研究者通过噬菌体展示技术快速合成了众多双特异性抗体AbTAC,一端结合RNF43,另一端结合PD-L1受体,从而可以将RNF43拉到PD-L1受体周围,进而通过内化和溶酶体的参与,实现PD-L1的有效降解。
AbTACs 已经在包括三阴性乳腺癌、非小细胞肺癌和晚期膀胱癌细胞系中测试了有效性。结果显示,在每个细胞系中,10 nM 的浓度下处理24 h后均可诱导PD-L1降解,表明这种基于抗体的PROTACs技术具有广泛的细胞适用性 。
另外,也有研究团队采用溶酶体靶向嵌合体,称为LYTACs,实现PD-L1的降解。
LYTAC技术是利用细胞降解蛋白质的机制来实现对于细胞外或细胞膜上的蛋白质进行降解,其原理是:LYTAC分子的靶蛋白配体首先与靶蛋白的胞外结构域结合,同时寡聚结构与细胞表面的LTR结合,三者形成LTR-LYTAC-靶蛋白三元复合物;而后,复合物经网格蛋白介导内吞进入细胞内,并经囊泡运送到早期内体中;随着内体酸化,三元复合物中的LTR解离并回到细胞膜或高尔基体,LYTAC与靶蛋白的复合物被继续转运至溶酶体中降解,其中LYTAC分子与蛋白解离后是否可以再次循环降解蛋白还有待进一步研究。

图9. LYTACs使用CI-M6PR运输蛋白进入溶酶体
2020年Nature期刊上刊登了一项LYTAC技术报道,研究者设计了LYTAC系统,对分泌蛋白和细胞膜外蛋白进行靶向降解。LYTAC系统包括2个主要部分,一部分是与待降解的底物蛋白对应的特异性抗体,可以特异性的结合需要降解的底物蛋白;该抗体与合成低聚糖肽配体结合,该配体结合阳离子非依赖性甘露糖-6-磷酸受体(CI-M6PR),这是一种跨膜糖蛋白,负责将蛋白质运输到溶酶体进行降解。并在基础实验中验证了对于PD-L1受体的降解效果。
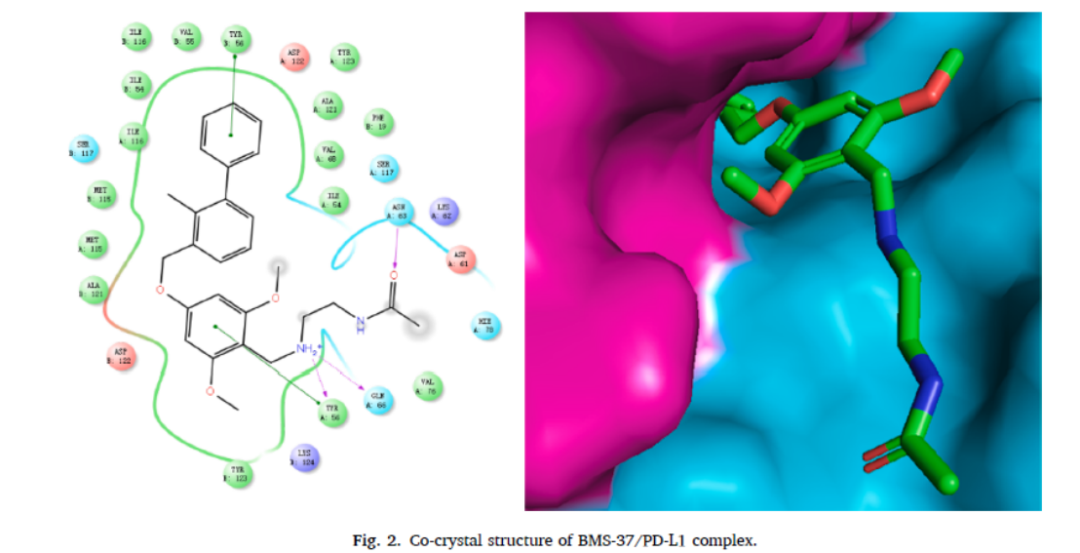
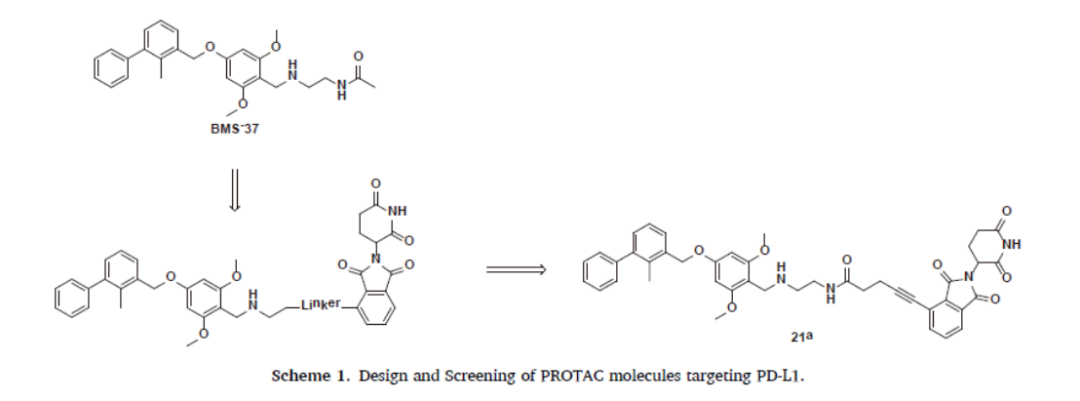
图10.BMS-37/PD-L1复合物晶体结构及PROTAC分子设计和优化
另外,施贵宝也在布局PROTAC领域,特别是如何有效介导PD-L1的降解。2021年,在Bioorganic Chemistry期刊上发表了基于小分子化合物的PROTAC技术的进展。
研究团队开发了一种新的PROTAC分子21a,以蛋白酶体依赖的方式有效地诱导各种恶性细胞中PD-L1蛋白的降解。此外,化合物21a可显著降低MC-38(免疫反应性小鼠肿瘤模型)体内癌细胞PD-L1蛋白水平,从而促进CD8+T细胞的侵袭,抑制肿瘤的生长。这种PROTAC分子可以作为肿瘤免疫治疗的一种新的替代策略。
总结
当然,PROTAC技术还存在非常多的缺陷,包括三联体成药性差、三元复合体形成困难、靶蛋白降解困难和可用的E3泛素连接酶数量有限等,但科学的突破总是在蜿蜒曲折中前行的。期盼PROTAC技术与免疫检查点的交汇,能为肿瘤治疗带来新的契机。
参考文献
[1] Nature Reviews Drug Discovery 20, 247-250 (2021).
[2] Nature Reviews Drug Discovery volume 21, pages181–200 (2022).
[3] J. Am. Chem. Soc. 2021, 143, 593−598.
[4]Bioorganic Chemistry 111 (2021) 104833
[5]J.Am. Chem. Soc. 2021, 143, 2, 593–598.
[6]Nature. 2020 Aug;584(7820):291-297.




 个人中心
个人中心
 我是园区
我是园区




