安进超 280 亿美元收购 Horizon,合源生物赫基仑赛报产,FDA 批准首款膀胱癌基因疗法… | Insight 新药周报
收藏
关键词:
新药癌周报安进FDA疗法生物基因收购药
资讯来源:Insight数据库 + 订阅账号
发布时间:
2022-12-18
据 In
sight 数据
库统计,上周(12 月 12 日 - 12 月 16 日)全球共有 37 款创新药(含改良新药)研发进度推进到
了新阶段,其中 4 款获批上市,4 款申报上市,11 款获批临床,5 款申报临床。从成分类别角度来看,除化药和单抗之外 ,CAR-T 疗法进展活跃,3 款发生了新进展,此外还涉及基因疗法、PROTAC、ASO 等。
下面,Insight 将分别摘取国内外部分重点项目做介绍。
国内方面,本周有 26 款创新药(含改良新药)
研发进度推进到了新的阶段
,
其中,首次获批上市 1 款,申报上市 1 款,获批临床 9 款,申报临床 2 款,首次公示临床试验的有 6 款。
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
勃林格殷格翰佩索利单抗在国内获批
12 月 14 日,勃林格殷格翰(Boehringer Ingelheim)宣布,其罕见皮肤病靶向生物制剂佩索利单抗(商品名:圣利卓/Spevigo)已获得中国国家药监局(NMPA)批准上市,用于治疗成人泛发性脓疱型银屑病(GPP)发作。
泛发性脓疱型银屑病(GPP)是一种罕见的、异质性的、危及生命的嗜中性粒细胞性皮肤病。患者的临床病程各不相同,有些患者的疾病复发并伴有反复急性发作,而另一些患者的疾病持续存在且间歇性急性发作。虽然GPP急性发作的严重程度各不相同,但若不及时治疗,出现败血症和多系统器官衰竭等并发症,可能会危及生命。
佩索利单抗是一款可阻断白介素-36 受体(IL-36R)激活的单克隆抗体,可抑制 IL-36 的信号传导,是中国首个获批专门用于治疗成人 GPP 发作的治疗药物。此前,该药已在中国被纳入突破性治疗品种和优先审评。
佩索利单抗的获批是基于其全球关键性 EffisayilTM 1 研究 2 期临床结果。该研究表明:54.3% 的患者经佩索利单抗治疗 1 周便达到皮肤无可见脓疱;42.9% 的患者经佩索利单抗治疗 1 周可达到皮肤症状清除或几乎清除。同时在整个研究中,佩索利单抗的安全性数据是可接受的,患者常见的不良事件包括发热和轻度至中度感染。
除用于 GPP 发作的治疗,佩索利单抗还被开发用于预
防 GPP 急性发作以及治疗其他嗜中性粒细胞性皮肤病,如掌跖脓疱病和化脓性汗腺炎。
针
对成人复发或难治性 B 细胞型急性淋巴细胞白血病
12 月 13 日, CDE 官网显示,合源生物 CAR-T 赫基仑赛注射液上市申请获受理(受理号:CXSS2200093),并于今日拟纳入优先审评,用于治疗成人复发或难治性 B 细胞型急性淋巴细胞白血病(r/r B-ALL)。
赫基仑赛注射液(CNCT-19 细胞注射液)是合源生物自主研发的一款靶向 CD19 的 CAR-T 细胞疗法。
12 月 12 日,合源生物在 ASH 年会上披露的关键
性临床研究数据显示,赫基仑赛在治疗成人复发或难治性 B 细胞型急性淋巴细胞白血病(r/r B-ALL)中展示出持久的高缓解率和显著降低的 CAR-T 治疗相关毒性严重性:
总体缓解率(ORR)达 82.1%,中位随访 9.3 个月时
,中位缓解持续时间(DOR)尚未达到。在 3 个月时仍缓解的患者中,1 年时预计有 80% 患者在持续缓解中。无论是否后续接受造血干细胞移植,均能表现出持续缓解和长期生存获益。
当前,据 Insight 数据库显示,全球已有 6 款靶向 CD19 CAR-T 获批上市,其中仅药明巨诺的瑞基奥仑赛、复星凯特的阿基仑赛在国内获批上市。
全球已获批 6 款靶向 CD19 CAR-T 疗法
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
不过,与赫基仑赛相比,这三者的适应症布局均有所差异:
瑞
基奥仑赛首发适
应症则为
r/r 大 B 细胞淋巴瘤(LBCL)
,在 2021 年
9 月获批;
此后,又在今年 10 月拓展了 r/r 滤泡淋巴瘤(FL)适应症;不过,针对 r/r B-ALL,药明巨诺也有布局,当前正在开展 I 期临床试验(登记号:CTR20220171),并在今年 6 月入组了首例受试者。
而阿基仑赛在 2021 年 6 月在国内首次获批适应症同样是 r/r 大 B 细胞淋巴瘤 (LBCL),不过是三线疗法。此后,又探索拓展至二线疗法,目前已处于上市申请阶段,且在今年 10 月被纳入优先审评(受理号:CXSS2200087)。暂未对 r/r B-ALL 有所布局。
当前国内尚未有针
对r/r B-ALL适
应症的 CAR-T 产品获批上市,赫基仑赛有望成为首款针对r/r B-ALL适应症的 CAR-T 产品。
此外,
针对 B-ALL 适应症,据 Insight 整理,目前共有 18 款国产 CAR-T 已进入临床阶段。除合源生物外,其余仍处于较早期阶段。
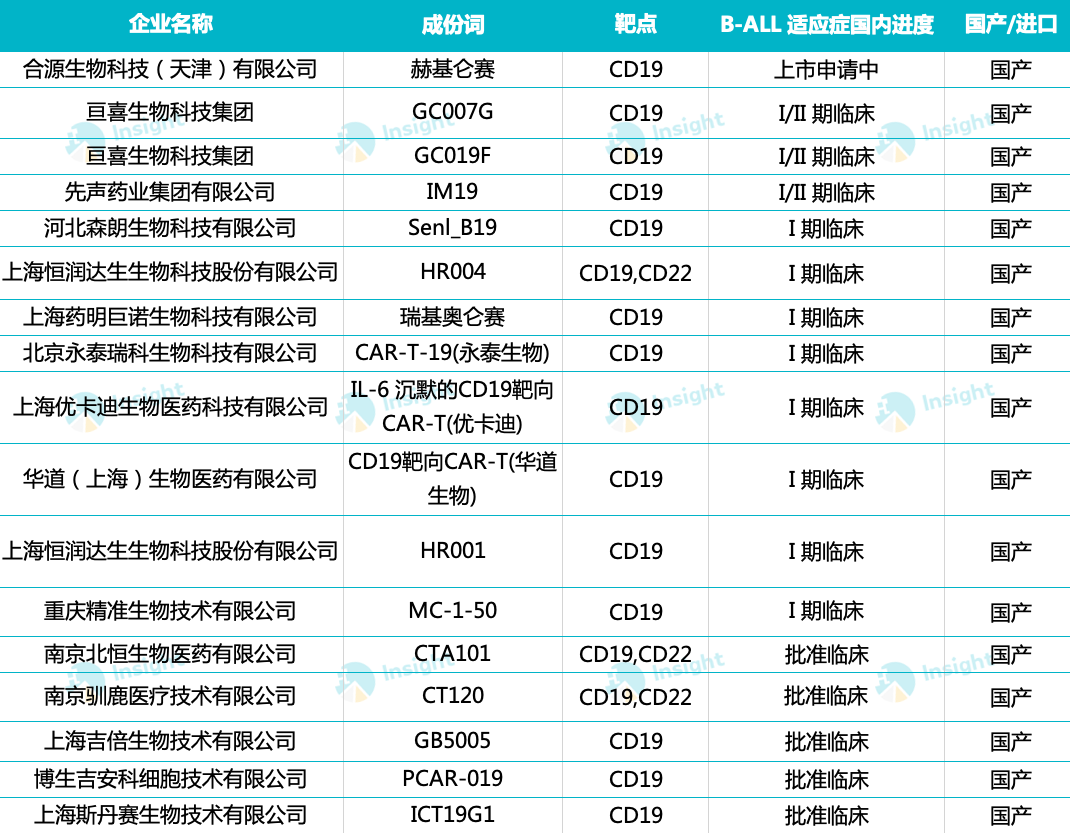
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
新药获批临床
1、礼来:心脏代谢新药 LY3819469 注射液
近日,据 CDE 官网显示,礼来心脏代谢新药 LY3819469 注射液在国内递交的临床试验申请获默示许可,用于降低已诊断 ASCVD 的患者或 ASCVD 高危患者的 Lp(a) 血浆稳态水平。(受理号:JXHL2200285)。
LY3819469 是基于 Dicerna 公司 GalXC™ RNAi 技术平台开发的一款 RNAi 候选药物。2018 年,礼来与 Dicerna 公司达成全球许可和研发合作,重点关注心脏代谢、神经退行性疾病和疼痛领域潜在新药的发现、开发和商业化。
根据协议条款,Dicerna 将获得 1 亿美元的预付款,以及 1 亿美元的股权投资。此外,Dicerna 将有资格获得高达 3.5 亿美元的开发和推广里程碑付款,以及产品销售分成。
LY3819469 是两家公司合作开发的第二款进入临床阶段产品,它是一款心脏代谢在研新药,其 IND 申请已于 2021 年 5 月获 FDA 批准,当前正在开展一项针对心脏代谢疾病的 I 期临床研究(登记号:NCT04914546)。
2、百吉生物:自体 T 细胞疗法 BRG01 注射液
12 月 14 日, CDE 官网显示,百吉生物申报的 1 类新药 BRG01 注射液获得临床试验默示许可,拟开发适应症为经标准治疗后失败且无有效治疗手段的末线复发/转移性 EBV 阳性鼻咽癌。
EBV 感染已被世界卫生组织定义为 I 类致癌物,与其相关的肿瘤主要包括鼻咽癌、 EBV 阳性的胃癌、淋巴瘤和淋巴细胞增生性疾病等。鼻咽癌(NPC)是一种发生于鼻咽部黏膜上皮的恶性肿瘤,是常见的头颈部恶性肿瘤之一,其发生发展与 EBV 的感染密切相关。近年来,免疫检查点抑制剂开始用于鼻咽癌的二线及以上治疗,然而总体反应率较低,患者仍然存在巨大的未被满足的临床需求。
BRG01 注射液是一款通过基因修饰技术将靶向 EB 病毒(EBV)抗原的受体表达于 T 细胞表面而制备成的自体 T 细胞免疫治疗产品,属于过继性免疫细胞治疗技术。其基本原理是:采集患者血液中的免疫细胞,在体外进行基因工程化改造,增强了 T 细胞对肿瘤细胞的特异性识别与杀伤效力,这些改造后的细胞回输进患者体内可以直接杀伤肿瘤,或激发机体免疫功能间接杀伤肿瘤,其安全性和有效性已在探索性临床中得到初步验证。

本周境外共有 16 款新药(含改良新药)研发进度推进到新阶段。其中 Adagrasib(商品名为 Krazati)、nadofaragene firadenovec-vncg(商品名为 Adstiladrin)等 4 款新药获批上市,avasopasem manganese(avasopasem)等 3 款新药申报上市......
此外,临床试验结果方面的亮点则首推个体化癌症疫苗 mRNA-4157/V940 联合 PD-1 抑制剂 Keytruda 治疗 III、IV 期黑色素瘤的 IIb 期临床研究
获得积极结果:
与
Keytruda
单药治疗相
比,该组合疗法可显著降低
III、IV 期黑色素瘤患者在肿瘤完全切除后的复发或死亡风险达 44%。
获批上市
1、 全球第二款 KRAS G12C 抑制剂获批!
再鼎医药拥有大中华区权益
12 月 12 日 ,Mirati Therapeutics 公司宣布,美国食品和药物管理局 (FDA) 已加速批准 Krazati (Adagrasib,研究代码为 MRTX849),用于经 FDA 批准的试验确定患有 KRAS G12C 突变的局部晚期或转移性非小细胞肺癌 (NSCLC) 的成年患者 。Krazati 是继 Lumakras 后第二个获批的 KRASG12C 突变靶向药。
RAS 基因驱动的癌症中有 85% 是由 KRAS 的突变引起的,90% 的胰腺癌,30~40% 的结肠癌,15-20% 的肺癌中都存在 KRAS 基因突变。在 KRAS 突变的肿瘤中,80% 的致癌突变发生在 12 号密码子中,最常见的突变位点有 KRAS G12D、 KRAS G12V 和 KRAS G12C。
Adagrasib 是一款高选择性的口服 KRAS G12C 抑制剂,其经过优化设计具有持久的靶点抑制能力,相关研究表明,该药的半衰期长达 24 小时,且组织分布广泛,耐受性好,在非小细胞肺癌、结直肠癌、胰腺癌和其他 KRAS G12C 突变的实体瘤中显示出单药疗效。
此次 Adagrasib 获批是基于一项多中心、单臂、开放标签临床试验 KRYSTAL-1 研究结果,入组者包括具有 KRAS G12C 突变的局部晚期或转移性 NSCLC 患者,对 112 名在铂类化疗和免疫检查点抑制剂同时或序贯给药期间或之后疾病进展的患者进行的疗效评估数据显示,Adagrasib 达到 43% 的客观缓解率(ORR),中位缓解持续时间(DOR)为 8.5 个月,最常见的不良反应包括腹泻、恶心、疲劳、呕吐、肌肉骨骼疼痛等。
据 Insight 数据库显示,目前全球已批准 2 款 KRAS G12C 抑制剂,即安进的 Lumakras(Sotorasib)和 Mirati Therapeutics 的 Krazati (Adagrasib),其中 Lumakra 于 2021 年 5 月获得美国 FDA 有条件批准上市,用于治疗既往至少接受过一次系统治疗的携带 KRAS-G12C 突变局部晚期或转移性非小细胞肺癌患者,成为全球首个获得批准的靶向 KRAS 突变的肿瘤治疗药物,其上市首年的全球销售额达到 9000 万美元。
此外,还有
超 20 款 KRAS G12C 抑制剂进入临床阶段,其中进展最快的是诺华研发的 JDQ443,已处于 III 期临床阶段。
2021 年 6 月,再鼎医药与 Mirati 公司达成合作,获得了 Adagrasib 在大中华区的研究、开发、生产及独家商业权利,此项合作总金额达 3.38 亿美元,包括 6500 万美元的预付款,以及高达 2.73 亿美元的开发、注册和销售里程碑付款。而安进的 Lumakras 中国地区权益则属于百济神州。
2、首款膀胱癌基因疗法获 FDA 批准
12 月 16 日,Ferring Pharmaceuticals 宣布,FDA 已批准基因疗法 nadofaragene firadenovec-vncg(商品名为 Adstiladrin)上市,用于治疗卡介苗(BCG)无响应的高风险非肌层浸润性膀胱癌(NMIBC)患者,这些患者伴有原位癌(CIS),可能携带或不携带乳头状肿瘤。
膀胱癌是最常见的癌症之一,NMIBC 约占所有新发膀胱癌病例的 75%。BCG 仍然是高级别 NMIBC 患者的一线治疗方法。然而,在接受 BCG 初始治疗的患者中超过 50% 在一年内出现疾病复发和进展的情况,其中许多发展为对 BCG 无应答的疾病。
Adstiladrin 是一种基于腺病毒载体的新型基因疗法,每三个月给药一次,通过导尿管注入患者膀胱,载体进入膀胱壁细胞,导致细胞分泌大量可对抗癌症的干扰素α-2b 蛋白。这种新型基因疗法将患者自身的膀胱壁细胞转变为干扰素微工厂,从而增强人体对癌症的天然防御能力。
Adstiladrin 是 FDA 批准的首款膀胱癌基因疗法,其获批是基于 III 期临床试验积极结果。该研究共纳入 157 例患者,其中 98 例原位癌患者伴有/不伴有高级别 Ta 或 T1(CIS±Ta/T1)。经过 3 个月 1 次 Adstiladrin 治疗后,有 51%(50/98)患者实现了完全缓解(CR);在达到初始 CR 的患者中,有 46%(23/50)在 12 个月时继续保持无高级别复发状态。
申报上市
12 月 12 日,Galera Therapeutics 宣布已向 FDA 递交 avasopasem manganese 的新药申请,用于正在接受标准护理放射治疗的局部晚期头颈癌 (HNC) 患者的严重口腔粘膜炎 (SOM) 。
口腔粘膜炎(SOM)是放射治疗的副作用,其特征是严重疼痛、炎症、溃疡和口腔出血。在头颈癌患者中,放射治疗是主要的治疗手段。大约 70% 接受头颈癌放疗的患者会发展为严重的口腔粘膜炎(SOM),定义为不能吃固体食物(3 级)或不能喝液体(4 级)。SOM 可导致放射治疗中断,从而对癌症治疗结果产生不利影响,这可能会损害许多此类患者在其他方面良好的肿瘤控制预后。目前还没有批准用于预防或治疗 SOM 的药物。
avasopasem manganese(AVA,GC4419)是一种选择性小分子歧化酶模拟物(small molecule dismutase mimetic),被开发用于降低局部晚期头颈癌(HNC)患者的放射性诱发严重口腔粘膜炎(SOM)和肺癌患者的放射性诱发食管炎,曾被FDA 授予快速通道和突破性疗法认定,用于减少放疗引起的 SOM。
NDA 的递交是 3 期研究 ROMAN 和 2b 期研究 GT-201 的数据,这些试验共招募了 678 名患者。 ROMAN 研究是一项随机、双盲、安慰剂对照研究,对 455 名局部晚期 HNC 患者进行了为期 7 周的标准放疗加顺铂治疗,旨在评估 avasopasem 降低因放疗诱发 SOM 的发生率和严重程度。2022 年 ASCO 年会上公布的研究结果显示:AVA 90 mg 显著降低该患者人群的严重口腔黏膜炎发生率,并减少患者严重口腔黏膜炎的持续时间,4 级口腔黏膜炎发生率也有所下降。
mRNA 组合疗法降低晚期癌症复发或死亡风险 44%
12 月 13 日,Moderna 与默沙东宣布其联合开发的个体化癌症疫苗 mRNA-4157/V940 和 PD-1 抑制剂 Keytruda 的组合疗法在 IIb 期临床研究KEYNOTE-942中获得积极结果。
KEYNOTE-942 试验是一项开放标签 IIb 期研究(登记号:NCT03897881),主要研究终点为无复发生存期(RFS)。研究共纳入 157 位受试者,结果显示,与 K 药单药治疗相比,mRNA-4157/V940 和 Keytruda 在 III、IV 期黑色素瘤患者进行肿瘤完全切除后,可在统计上显著并具临床意义地改善 RFS,且可患者复发或死亡风险降低 44%(HR=0.56,95% CI:0.31-1.08;单侧 p 值=0.0266)。
这是 mRNA 疫苗首次在随机临床试验中展现出治疗黑色素瘤的效力。两家公司表示,预计将于 2023 年启动针对黑色素瘤患者的 III 期临床研究。
本周或诞生今年医药圈最大的并购案。
12 月 12 日,
安进
宣布将以 116.50 美元/股,总额约 283 亿美元
的价格收购
Horizon Therapeutics。
Horizon 是一家专注于罕见病和风湿病的生物制药公司。目前 Horizon 已有多款产品获批上市:Tepezza、Krystexxa、Uplizna 以及 Ravicti,分别用于治疗眼科罕见病、慢性痛风、视神经和脊髓炎症以及罕见遗传疾病尿素循环紊乱。此次收购将进一步补充安进罕见病药物管线。
1、12 月 13 日,武田(Takeda)宣布将从 Nimbus Therapeutics 收购 NDI-034858。NDI-034858 是 Nimbus Therapeutics 开发的一种变构 TYK2 抑制剂,正在评估其用于治疗多种自身免疫性疾病的效果,目前已在针对银屑病的 2b 期临床中取得成功。武田计划在 2023 年初公布这项 2b 期研究的数据,并在 2023 年推进银屑病 3 期临床试验。
而据协议,武田将向 Nimbus 预付 40 亿美元,并在实现年度净销售额 40 亿美元和 50 亿美元后分别向 Nimbus 支付 10 亿美元的两笔里程碑付款。
2、
12
月 15 日,信达生物与 LG 化学旗下的 LG 化学生命科学(下称「LG 化学」),宣布就 LG 化学研发的临床后期创新药物 Tigulixostat(LG 研发代号: LC350189, 信达生物研发代号: IBI350)达成战略合作和许可协议。
Tigulixostat 是一款治疗痛风患者高尿酸血症的全新非嘌呤类似物黄嘌呤氧化酶抑制剂(XOI),通过抑制黄嘌呤氧化酶活性,阻止次黄嘌呤和黄嘌呤代谢为尿酸,从而减少尿酸生成。
在一项于美国完成的 2 期临床研究(CLUE 研究)中,Tigulixostat 在所有剂量组均展现出良好的降血尿酸水平(sUA)作用,并且和安慰剂及非布司他(Febuxostat)相比,Tigulixostat 在治疗 3 个月后所有剂量组均达到了 sUA<5 mg/dL 的主要临床终点。LG 化学已于 2022 年第四季度启动 Tigulixostat 的国际多中心 3 期临床研究。
免责声明:
本文仅作消息分享,
并不构成投资建议,也不代表 Insight 数据库的立场,文章观点仅供分享行业见解,请广大投资者谨慎。
投稿:微信 insightxb;邮箱 insight@dxy.cn
免费试用 Insight 数据库
















 个人中心
个人中心
 我是园区
我是园区




