「南京学派」张辰宇:体内自组装的第三代RNAi治疗技术进入产业化,显著提高药物效果及靶向性,首推管线将于年内进入临床阶段
收藏
关键词:
进入临床
资讯来源:DeepTech深科技 + 订阅账号
发布时间:
2022-02-27
自 1993 年 microRNA(miRNA)首次被发现以来,大多数科学家都认为它与其他形式的 RNA 一样,仅存在于细胞内。但南京大学生命科学学院院长张辰宇却推翻了这一观点,并随之开创了针对于细胞外 RNA(exRNA)研究的学术体系。
发展至今,基于胞外 RNA 的研究工作不仅有助于解开细胞间和物种间交流中存在的谜团,并且还将创造出新的诊断和治疗方法。
近期,专注于小核酸药物研发的艾码生物(ExoRNA Bio)宣布完成数千万元天使轮融资。本轮融资由鼎晖投资 VGC 基金领投,某业内知名 CRO 跟投。
据悉,艾码生物基于南京大学教授、生命科学院院长张辰宇自研的第三代 RNAi 药物体内递送平台技术,将为未满足的临床需求带来创新性的治疗方案。
本轮融资之后,艾码生物将快速推进脑神经性疾病核酸药物,和抗超级菌、抗病毒感染性疾病核酸药物的研发及生产工作。
鼎晖投资高级合伙人柳丹博士表示:
目前核酸药物临床存在的最大问题,在于缺乏更好更有靶向性的体内递送体系,而张辰宇教授的研究突破了这一瓶颈。
“以其发明的第三代 RNAi 药物体内递送平台为技术基础,不仅
改善了原来的单一肝靶向问题,还能穿过血脑屏障或靶向其它脏器。
在核酸药物快速发展的大背景下,艾码生物具有‘核酸药物 + 递送’的双平台领先性,具备极大优势。” 柳丹补充说。
基于外泌体破解 RNAi 药物递送难题
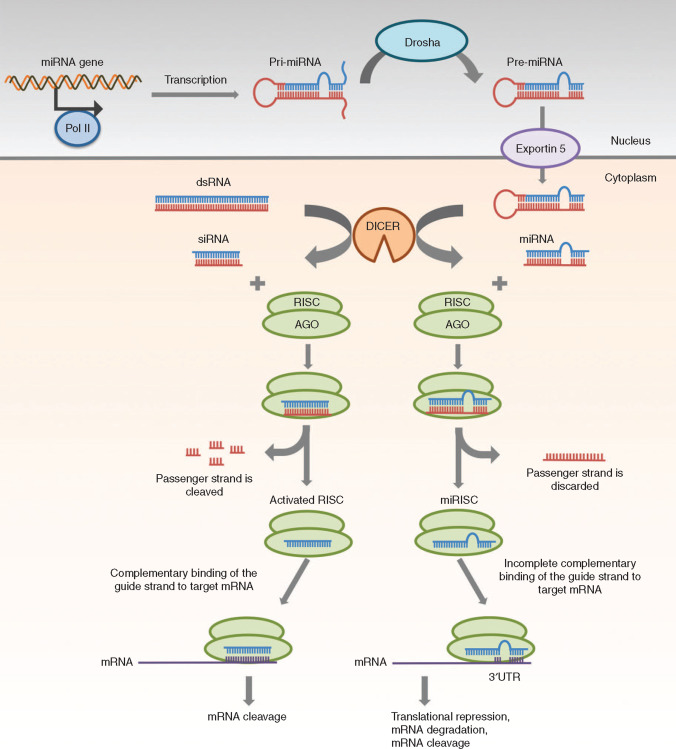
小干扰 RNA(siRNA)最早由英国的 David Baulcombe 团队发现,是植物中的转录后基因沉默现象的一部分。2001,Thomas Tuschl 团队发现合成的 siRNA 能够介导哺乳动物体内的 RNA 干扰(RNAi)作用。
从物理化学性质角度来看,siRNA 和 miRNA 有很多相似之处:
都是短的双链 RNA 分子,通过靶向信使 RNA(mRNA)在转录后水平发挥基因沉默作用。
作为 RNAi 药物来说,二者均具备较大潜力,并且适用于类似的递送方式。
图丨 siRNA 和 miRNA 的基因沉默机制(来源:Molecular Therapy Nucleic Acids)
作为在基因调控中具有重要作用的非编码 RNA,siRNA 通过靶向信使 RNA(mRNA)发挥基因沉默作用,并且具有高度特异性。发展至今,在 siRNA 药物研究领域中已涌现出用于治疗包括遗传疾病等多种疾病的新型治疗剂,并持续带动着研究热潮。
张辰宇针对 RNA 开展研究工作近二十年,其研究内容囊括了 microRNA、siRNA、自复制 RNA、环状 RNA 等多个领域,取得了以 RNAi/siRNA、“循环 miRNA 生物标志物”、“分泌 miRNA 通讯交流系统”、“外源植物 miRNA 跨界调控”、“外泌体递送第三代 RNAi 治疗技术” 为代表的大量研究成果。并形成被国际顶尖学术期刊 Nature 称作 “南京学派” 的 “胞外 RNA 介导物种间共进化与适应” 学术体系,被业内誉为 “
国际细胞外 RNA 研究第一人
”。
多年来,张辰宇致力于将原创性基础研究成果转化为国际领先的实际临床应用。目前已拥有百余项国际和国内发明专利,部分已经实现转化应用。其研发的世界上第一个基于循环 miRNA 的胰腺癌诊断试剂盒,已于 2015 年 11 月获国家食品药品监督管理总局(后更名为国家药品监督管理局)批准上市,早癌诊断准确率达 87.6%。
早在 2008 年,
张辰宇团队率先发现 miRNA 能够借助外泌体在细胞外稳定存在,
论文发表于国际顶级期刊 Cell Research。该发现开创了血清 miRNA 生物标志物研究的基础,推动了此后诸多科研团队和企业的相关研究进展。
截至目前,Cell Research 显示该论文被引用 3167 次,成为中国学者被引用数量最多的论文之一。
“早期研究认为,RNA 在细胞外环境中无法稳定存在,因为血清中的核糖核酸酶会导致 RNA 降解。因此当我们提出检验是否存在细胞外 miRNA 时,许多人都认为这个想法很疯狂。” 张辰宇介绍道。
其研究成果挑战了 RNA 在细胞外环境中不稳定的传统观点。此后,越来越多的证据表明,miRNA 在包括唾液,尿液和母乳在内的细胞外生物体液中以稳定、无细胞形式循环。
另一方面,
小核酸药物长期以来面临着递送困难的挑战。
此前,第一代小核酸药物是以合成或化学修饰的方式获得稳定的 siRNA,第二代则通过各种递送载体(例如纳米脂质颗粒、阳离子聚合物、病毒载体等)提高 siRNA 的体内递送效率。
尽管研究人员基于化学修饰、生物共轭以及使用纳米颗粒或脂质体包裹等多种技术手段,以提高药物的稳定性和靶向性,
但该类药物仍然存在剂量毒性、免疫相容性低、循环稳定性不足等问题。
以胞外 RNA 的发现为契机,研究学者们逐渐意识到,外泌体可以作为一种天然来源的药物载体。2013 年,James E. Rothman、 Randy W. Schekman 和 Thomas C. Südhof 三位科学家因 “发现细胞内的主要运输系统 —— 囊泡运输的调节机制” 获诺贝尔生理学或医学奖,外泌体因此获得更多关注。
外泌体载体不仅具有高稳定性、高选择性的优势,并且其与核酸分子有更好的亲和性,能够显著提高包封和递送效率。除此之外,在最新的研究成果中,外泌体还可以透过血脑屏障发挥作用,具有广阔的应用前景。
在早期的研究基础之上,张辰宇通过进一步研究,深入探索了外泌体作为小核酸药物递送载体的潜力。
用量低至1/40,自主修饰药物或将降低药量及副作用
2015 年,基于外泌体的疾病诊断和精准医疗基础研究逐渐升温,专注于外泌体方向的生物科技公司开始在市场中崭露头角,逐步推进外泌体的产业化进展,其中不乏知名机构与企业。
例如,著名生物医疗风投机构 Flagship Pioneering 于 2015 年孵化 Codiak BioSciences,以外泌体作为递送载体开展药物研发工作。2016 年,长期领跑外泌体诊断领域的 Exosome Diagnostics 推出全球首款外泌体癌症诊断产品,用于检测非小细胞肺癌的基因突变。
据不完全统计显示,目前全球有近 50 家企业开展外泌体相关研究。其中,近 2/3 的企业已针对外泌体相关药物展开布局,适应症主要集中于肿瘤、脑部疾病、疫苗开发、基因治疗 / 罕见病四个领域。
尽管在核酸治疗和外泌体研究领域具备深厚的工作基础,但彼时的张辰宇并没有跟随早期的研究转化风潮。
早期的外泌体递送策略需要在体外将 siRNA 与载体或配体预组装。然而,人工复合物仍有免疫相容性低、毒性高、循环稳定性不足和组织可及性受限的问题。因此,
业内普遍认为外泌体距离大规模产业化还很遥远。
“其中一个问题在于,
体外生产的外泌体很难保证产品的均一性,而且产量不高,难以支持产业转化。
另一方面,体外合成 siRNA 成本高,并且最重要的是,
体外合成的 siRNA 和体内 siRNA 的自主修饰之间存在差距,有时不能形成 RNA 诱导沉默复合体(RISC),难以发挥药效。这就导致了更高的药物用量,产生较大毒副作用。
” 张辰宇解释道。
一种由 siRNA 与 Argonaute 蛋白和 Dicer 酶复合形成的复合物。在 RNAi 中,其利用 siRNA 的反义链切割靶 mRNA,从而实现基因沉默。
2021 年 3 月,张辰宇及其团队历时十余年的重要研究成果在 Cell Research 公开发表。
该论文中,研究团队设计了可组合和可编程的遗传电路,以肝脏作为组织底盘,将外源 siRNA 引导至分泌性外泌体中实现自组装,进而实现 siRNA 在体内的靶向递送。
在此基础上,发展形成第三代 RNAi 药物体内递送技术平台。
图丨通过静脉注射组合核心电路进行体内组装和递送 siRNA 示意图(来源:Cell Research)
这一技术策略不仅规避了 RNAi 疗法载体体外生产成本高、质控难度大等问题,更重要的是,
其在药物浓度极低的情况下,也能够发挥出强大作用。
临床前试验数据表明,以导致亨廷顿舞蹈症的 Huntingtin 基因作为药物靶点时,使用体内自组装的 siRNA 药物进行治疗仅需 5mg/kg 即可起效,远远低于常规药物 200 mg/kg 用量。
加快推进产业化进程,预计年内正式开展临床
近两年来,得益于全球范围内 mRNA 疫苗的广泛应用,相关业内与投资界对于核酸药物的认知与期望空前高涨。
2018 年,
FDA 批准了 Alnylam 制药公司开发的 RNAi 药物 Patisiran,
用于遗传性 ATTR 淀粉样变性成人患者第 1 阶段或第 2 阶段多发性神经病的治疗。全球首个 RNAi 生物技术药物的获批,标志着 RNAi 治疗时代的开始。
2021 年 3 月,加拿大生物制药公司 Bioasis Technologies(TSXV:BTI;OTCQB:BIOAF)宣布加入 siRNA 药物竞争赛道。该公司利用 xB3 平台将 siRNA 递送到大脑中,即利用肽段偶联 siRNA 穿透血脑屏障,以治疗中枢神经系统疾病。
借助研究进展与市场繁荣的共同契机,2021 年,张辰宇教授与多位资深创新药研发及管理人才共同创立了艾码生物。
其中,曾在 Transgene、西比曼等知名企业任职高管,拥有 20 年以上研发、市场、商务和管理经验的孟夏博士担任 CEO 和联合创始人,她将主要负责艾码生物的运营和管理。
中国科学院院士、中国科学院核酸生物学重点实验室学术委员会主任陈润生将担任该公司的科学顾问,此外还有多位来自知名生物技术企业的科学家担任要职。
“未来艾码生物将聚焦递送平台和相关药物的研发工作,” 张辰宇介绍,目前,
艾码生物专注于推进中枢神经系统疾病、感染和肿瘤等疾病治疗管线。
“我们在合成生物学基因组件上做了一些修饰,使得原来不能通过血脑屏障的外泌体能够通过血脑屏障,以治疗中枢神经系统疾病。” 张辰宇补充道。
其实,自组装外泌体技术的安全性和有效性已在人体完成初步验证,展现了较好的人体内安全性和有效性。具体到研发管线而言,针对于亨廷顿舞蹈症、肿瘤等适应症管线已完成动物模型试验。
据张辰宇教授估计,
其首推产品管线将于今年内进入 IND 申报阶段,正式开展临床,
未来将持续推进创新核酸药物技术的产业化进程。
截至目前,
全球范围内已有四款 RNAi 药物获得 FDA 或 EMA 批准上市,
均由 Alnylam 及其合作公司开发,并且仅在部分地区获批上市。
该四款药物均属于第一代 siRNA 药物,即通过人工合成和化学修饰的方式完成制作加工,以便提高稳定性并躲避免疫系统识别,继而通过局部注射的方式进行治疗。
联合创始人孟夏认为,目前核酸生物学已经到达行业爆发的时间节点,市场前景广阔。以张辰宇教授多年的研究积累为基础,艾码生物不仅以 “核酸药物 + 递送” 的双平台领先性为优势,并且具有经过临床实际验证的小 RNA 核酸药物,未来将在该赛道中占据优势地位。
https://www.sciencedirect.com/science/article/abs/pii/S0142961219302571#!
https://patents.google.com/patent/US20160273054/enIt
https://www.sciencedirect.com/science/article/pii/S2162253116300373
https://www.nature.com/articles/s41422-021-00491-z#Sec2
















 个人中心
个人中心
 我是园区
我是园区




