
一款药物,有望治疗好几种疾病?世上真有“这等好事”?在化学家眼里,其使命之一便是“点石成金”,一药多用自然也在他们的研究之列。
近年来,复旦大学化学教授兼中科院上海有机所特聘研究员黎占亭,专注于借助超分子化学原理开展药物设计研究。他曾先后在 2013 年和 2014 年,报道了首例二维 SOF 结构(Supramolecular Organic Framework,超分子有机框架)、以及三维 SOF 结构。
随后,这一“领军型”研究也掀起一股风潮:国内外课题组先后成功构筑出数十种 SOF,并开发出 SOF 在能源、催化、生物医药领域的多种应用功能。

图 | 黎占亭(来源:黎占亭)
几年前,黎占亭曾报道过超分子有机框架的药物递送功能。最近,他又报道了基于 SOF 框架的肝素类的抗凝血药物的拮抗活性、以及肿瘤光治疗后的光毒性抑制和疗效增强等成果。
5 月 2 日,相关论文以《多孔聚合物通过包合-螯合机制作为肝素抗凝剂的通用逆转剂》(Porous Polymers as Universal Reversal Agents for Heparin Anticoagulants through an Inclusion–Sequestration Mechanism)发表在 Advanced Materials 上[1]。

图 | 相关论文(来源:Advanced Materials)
由该论文可知,生物相容性也是探索 SOF 药用潜力的一个关键因素。作为隔离或递送载体,SOF 的用量要超过被吸收药物,这意味着 SOF 必须具备很好的生物相容性。国外研究已经确定的是,CB[8] 自身的毒性很低。
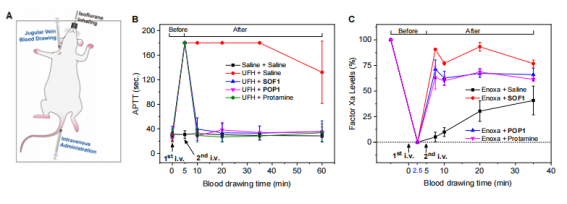
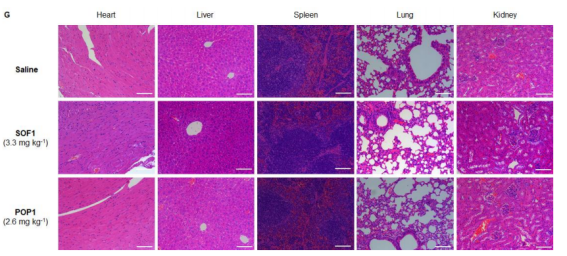
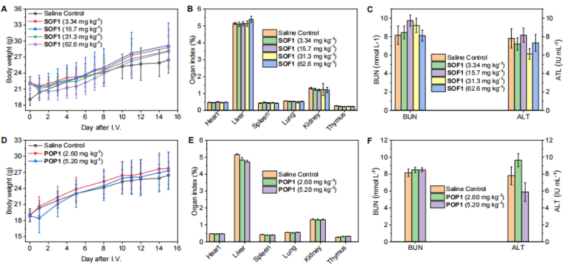
而黎占亭团队发现,四面体单体的取代基,对 SOF 的体内毒性影响很大。目前,该课题组已筛选发现了一个 SOF 结构,它具有较低的自身毒性。基于动物模型的研究也表明,针对肝素药物拮抗和卟吩姆钠疗后光毒性抑制的剂量,该 SOF 结构完全可以满足。而安全性评价,则是该团队后续要开展的工作,因此未来他们首先要建立体内组装体和单体定量的方法。
另据悉,该团队通过细胞模型和动物实验,进行了 SOF 的安全性评估。结果发现,通过主体分子大环 CB[8] 结构,对正离子型结构单元进行包结,可以大大降低因结构存在的正离子直接暴露所带来的生物毒性,这也为保持利用正离子特性、以进行药物负载的同时,还可降低毒性的材料设计提供了思路。
同时,由于 SOF 结构具有的高度稳定性,在对人血和动物血浆的研究中,黎占亭并未发现 SOF 结构会破坏血液中蛋白、或细胞因子所具有的生物功能。令人欣喜的是,注射 SOF 后的活体动物的各项血液功能指标均正常,这也说明 SOF 结构具有较低的体内毒性。
(来源:Advanced Materials)
中和效率均在 90% 以上,有望实现一药多用

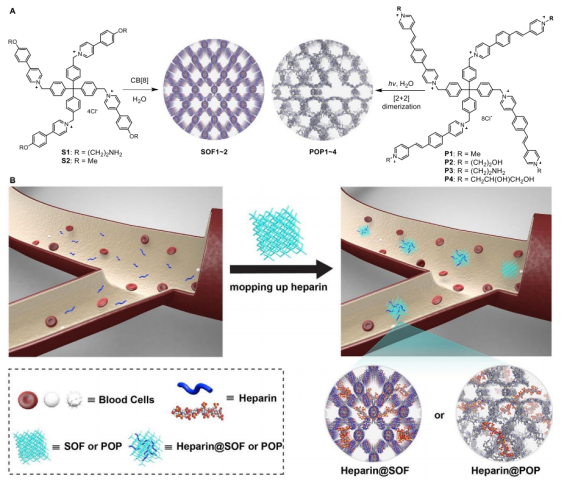
该团队发现,SOF 能有效中和所有肝素类抗凝血剂,且中和效率均在 90% 以上,是一个广谱的肝素类药物拮抗剂,如果成功将具有不错的社会价值和经济效益。
具体来说,正离子型四面体分子、以及葫芦 [8] 脲(Cucurbit[8]uril, CB[8])有机大环,通过非共价键组装的方式,便可成为 SOF。
同时,SOF 也是一类具有水溶性的有序纳米孔道材料。另据悉,SOF 还具备良好的生物相容性,因此它在生物医药领域的应用,也被认为是最具发展前景和应用价值的方向之一。
而黎占亭团队主要借助 SOF 来开展药物递送研究。药物递送是提高临床药物综合疗效的主要手段,尽管脂质体技术商业化已经很久,各种纳米技术的应用也都各有优点或特色,但仍有一些不足等待解决。
该课题组发现,SOF 能十分高效地吸收和富集药物和核酸。目前,该团队的研究重点是,利用 SOF 的结构特点去挖掘独有的应用。他认为,对肝素类抗凝血药物的拮抗、以及卟吩姆钠疗后光毒性的抑制,最能发挥 SOF 的优点。在该抑制过程中,不仅能体现超分子化学的多价性结合,还能避免体内药物控制释放这一世界性难题。
SOF 应用于药物递送的一个独特之处,在于可以原位负载药物,从而避免脂质体技术等复杂的药物包埋步骤。要知道,脂质体药物包埋技术非常复杂,生产工艺和质量控制也极具挑战性,而且还难以量产。另外,脂质体的稳定性较低,需要低温运储,单体也非常昂贵。
而 SOF 由两个有机分子组装而成,成分可被精确控制,不仅稳定性高,还可长期室温放置。此外,SOF 的离子特性,让其具备良好的水溶性,而其内部孔道则具备疏水性。再就是,SOF 是个有序的柔性框架,在水中会产生一个孔道有序排列的类海绵结构,它还具备较大的孔径(2~4 纳米),因此能吸附很多药物或生物活性分子。
(来源:Advanced Materials)
此外,吸附过程往往也很快,当把药物加到 SOF 溶液中,搅拌溶解之后就能达到平衡。也就是说,这是一个非常简单的扩散控制的过程。由此而生的潜在应用场景是,SOF 能否在体内快速吸收一些过量药物、或残留药物?
要知道,很多药物在体内过量或残留时,都会产生毒性或副作用,严重时可导致患者死亡。如果 SOF 对这些药物的吸收效率足够高,自身毒性又足够低,则有望通过对药物进行体内吸收隔离,从而减缓或消除残留毒性,最终实现多疾病治疗的目的。以上,便是黎占亭开展这一系列研究的初衷,亦是他的研究目标。
期间,他把药物递送作为用 SOF 实现多疾病治疗研究目标的组成部分之一。其表示:“我们通过动物模型验证了 SOF 针对上述不同药物的活性。如果后续可以完成一种 SOF 候选结构的安全性评价,就能同时针对不同药物开展药效评价,争取实现 SOF 的‘一药多用’,这样有助于降低后续研究成本,提高成功几率。”
“多疾病治疗”愿景:四类药物均能进入 SOF 孔内

由于 SOF 是一类正离子聚电解质型的有机框架,孔道开口可达 2-4 纳米,并且内穴具有很强的疏水性。对于任何药物分子,只要尺寸合适、疏水性足够高、或带有一定数量的负离子,都可通过疏水作用、离子对静电吸引作用、或二者的协同效应,从而被 SOF 吸收。
通过 SOF 结构对药物的吸收,可从三方面实现不同场景下的疾病治疗目的:
-
针对药物使用过量,通过 SOF 拮抗药效实现治疗; -
针对药物毒性的体内长期残留问题,通过 SOF 清除实现治疗; -
针对相关疾病,通过 SOF 对药物的原位负载和输送实现治疗。
-
一是肝素类抗凝血药物,SOF 的吸收可有效抑制溶血或极性出血毒性; -
二是 PDA(Polydopamine,聚多巴胺)药物卟吩姆钠、他拉泊芬和喜泊分等。SOF 的吸收,可以抑制患者在接受抗肿瘤光动力治疗后、体内残留导致的长期光毒性; -
三是阿霉素、培美曲塞等,SOF 通过递送和控制释放,提高了它们的抗肿瘤活性; -
四是替莫卟吩,SOF 的吸收和递送可提高抗肿瘤光动力治疗的抗肿瘤效力。






 个人中心
个人中心
 我是园区
我是园区




