「 本文共:16条资讯,阅读时长约:3分钟 」


绿叶精神分裂症长效新药报产。绿叶制药自主研发的第二代抗精神病长效针剂棕榈酸帕利哌酮注射液(LY03010)的上市申请获CDE受理,拟每月给药一次,用于精神分裂症急性期和维持期的治疗。今年11月,LY03010在美国开展的用于治疗精神分裂症和分裂情感性障碍的关键临床(Invega Sustenna)达到预期终点,绿叶制药计划通过505(b)(2)的途径提交新药上市申请。


1.诺诚健华引进CD19单抗获批香港上市。诺诚健华从Incyte公司引进的CD19单抗药物tafasitamab(Minjuvi®)获香港卫生署批准,联合来那度胺用于治疗不适合自体干细胞移植条件的复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者。Tafasitamab联合来那度胺用于上述适应症已获得FDA和EMA有条件批准上市。除DLBCL适应症外,Tafasitamab目前还被开发用于多种肿瘤治疗,进展最快为滤泡性淋巴瘤和边缘区淋巴瘤。
2.泰它西普启动干燥综合征Ⅲ期临床。荣昌生物BLyS/APRIL双靶点融合蛋白泰它西普登记启动一项Ⅲ期临床,评估用于治疗原发性干燥综合征患者的有效性和安全性。Ⅱ期临床结果显示,在全分析集和符合方案集分析中,与安慰剂相比,泰它西普160mg组患者12周和24周的ESSDAI评分均较基线显著降低。该新药此前已获NMPA批准上市,用于治疗系统性红斑狼疮。
3.BMS分子胶降解剂启动国际Ⅲ期临床。百时美施贵宝分子胶降解剂CC-92480(mezigdomide)登记启动一项国际(含中国)Ⅲ期临床(CA057-001),在复发性或难治性多发性骨髓瘤(MM)患者中比较CC-92480、硼替佐米和地塞米松与泊马度胺、硼替佐米和地塞米松的无进展生存期(PFS)。计划国际入组760人,中国入组112人。首都医科大学附属北京朝阳医院陈文明博士将担任该项试验中国部分的主要研究者。
4.阿兹夫定获批开展暴露后预防新冠临床。真实生物与复星医药合作的新冠口服药阿兹夫定获菲律宾监管部门批准开展一项II/III期临床试验,计划在有症状新冠感染者的家庭密切接触者中评估阿兹夫定对比安慰剂预防新冠感染的有效性和安全性。该项研究的主要终点为7天内RT-PCR方法检测新型冠状病毒阳性的受试者比例。阿兹夫定是新型核苷类逆转录酶和辅助蛋白Vif抑制剂,此前已获批用于治疗艾滋病。
5.智康弘义TIM-3单抗获批临床。智康弘义1类生物制品BC3402注射液获国家药监局临床默示许可,拟开展Ⅰb/Ⅱ期临床,联合去甲基化药物等化疗药物治疗恶性血液疾病(包括但不限于骨髓增生异常综合征、急性髓系白血病、慢性粒单核细胞白血病等)。该公司同时宣布FDA也批准在美开展BC3402单药治疗恶性血液疾病的Ⅰ期临床研究(包括骨髓增生异常综合征和慢性粒单核细胞白血病等)。
6.诗健抗肿瘤抗体获FDA临床批准。应世生物与诗健生物联合开发的抗体新药INES103获FDA临床许可,将针对晚期或转移性实体瘤在美国开展临床试验。INES103是一款人源化单域抗体(VHH)- Fc融合蛋白,诗健生物拥有其分子专利。INES103分子量仅为经典IgG的一半的独特设计,使得该分子在保留较长血浆半衰期的同时,具有良好的肿瘤组织穿透性。今年10月,CDE受理了该新药的IND申请。
7.复宏汉霖与复星达成美国市场合作。复宏汉霖宣布就PD-1斯鲁利单抗(汉斯状®)与复星医药达成合作。根据协议,复星医药将负责斯鲁利单抗在美国市场的商业化活动;复宏汉霖将负责该新药在美国上市的产品开发、生产和供应;复宏汉霖将获得10亿人民币的首付款、潜在监管和销售里程碑付款及特许权使用费。斯鲁利单抗今年3月已在国内获批上市,用于治疗微卫星高度不稳定(MSI-H)实体瘤和鳞状非小细胞肺癌。


1.苯丁酸钠获批治疗尿素循环障碍。Acer Therapeutics与Relief公司开发的苯丁酸钠口服混悬剂ACER-001获FDA批准上市,用于治疗罕见遗传疾病尿素循环障碍(UCD)患者。UCD是由基因突变导致的氨合成尿素发生障碍,导致游离氨在体内储存过多而形成的高氨血症。ACER-001是一种氮结合剂,用于涉及氨甲酰磷酸合成酶(CPS)、鸟氨酸氨基转移酶(OTC)或精氨琥珀酸合成酶(AS)缺陷的UCD患者的辅助治疗。
2.Hetero推首款世卫预审新冠口服仿制药。印度公司Hetero研发的新冠口服抗病毒药物奈玛特韦(Nirmacom)获世卫组织药物资格预审计划(WHO PQ)批准。Nirmacom是首个获WHO PQ认证的辉瑞新冠口服药PAXLOVID仿制药,与利托那韦组合包装,将用于诊断出新冠肺炎后五天内服用,治疗住院风险较高(未接种疫苗、高龄或免疫抑制等)的轻症和中症新冠肺炎患者。Nirmacom将由Hetero位于印度的工厂生产。
3.吉利德与Jounce就CCR8抗体修改合作协议。吉利德宣布与Jounce Therapeutics修订2020年双方就CCR8单抗JTX-1811签署的许可协议,将买断许可协议下的剩余义务。根据新协议,Jounce将获得6700万美元的收益,此外不再有权获得任何里程碑付款或特许权使用费,即6.45亿美元里程碑和基于原许可协议的全球销售额的高个位数至中位数的版税。吉利德将获得某些相关的知识产权,包括Jounce对GS-1811的所有剩余权利。
4.默沙东与PeptiDream达成肽偶联药物合作。默沙东与PeptiDream公司达成合作和许可协议,将利用PeptiDream专有的肽发现平台系统(PDPS)技术,合作发现和开发针对多个靶标的新型肽偶联药物(PDCs)。根据协议,PeptiDream将获得一笔预付款,总额高达21亿美元的开发、批准和销售里程碑潜在付款,以及合作产品的销售分成。默沙东将拥有多肽偶联药物(PDC)的独家权利。


1.新冠疫情监测聚焦7个方面。12月27日,国务院联防联控机制综合组发布《新型冠状病毒感染“乙类乙管”疫情监测方案》,明确监测内容分为病例报告监测、核酸和抗原检测监测、哨点医院监测、重点机构监测、学生症状监测、病毒变异监测以及新冠病毒污水监测共7类,以便及时动态掌握人群感染发病水平和变化趋势,动态分析病毒株变异等情况,为疫情防控提供技术支撑。
2.北京为高风险人群发放血氧夹。北京市卫健委、医疗保障局印发《关于进一步提升重症救治服务能力的通知》。其中要求,加强居家监测服务,组织对老年人等高风险人群发放血氧夹;指定二级以上医疗机构对口负责养老院、福利院等机构老年人的健康监测和就医服务;鼓励各区在社区卫生服务机构为有需求的居民提供氧气灌装服务。
3.诊所管理全面进入“备案时代”。日前,国家卫健委会同国家中医药管理局制定的《诊所备案管理暂行办法》及《诊所基本标准(2022年版)》发布。《诊所备案管理暂行办法》明确,单位或者个人设置的诊所在取得诊所备案凭证后即可开展执业活动,进一步简化诊所设立程序,并强化诊所执业管理。至此,我国对所有诊所的管理从审批制全面转入备案制。
4.国家罕见病医学中心设置标准发布。近日,国家卫健委印发《国家罕见病医学中心设置标准》,明确国家罕见病医学中心应依托罕见病诊治水平突出的三级甲等综合医院,且该医院应该具备参与罕见病新药临床试验≥30项(其中作为组长单位或国际多中心临床研究国内牵头单位开展的项目≥10 项),能常态化开展罕见病多学科诊疗(MDT)工作等四个基本条件。


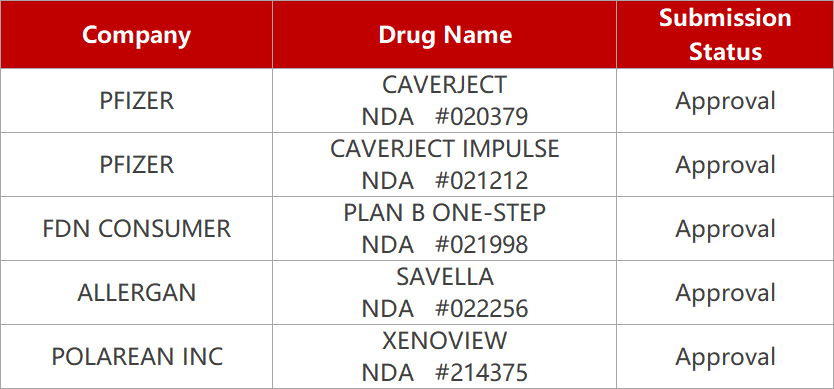
1. CDE新药受理情况(12月28日)



上个交易日 A 股医药板块 -0.03%
涨幅前三 跌幅前三
江苏吴中 +10.04% C 川 宁 -5.77%
华海药业 +10.02% 翰宇药业 -5.23%
海 思 科 +10.02% 德展健康 -4.98%
【康希诺】公司的吸入用新冠疫苗、肌注式新冠疫苗及O株/原始株双价吸入用新冠疫苗开展了多项拓展性临床研究,目前已获得阶段性数据。
【普利制药】注射用更昔洛韦获得斯里兰卡国家药品监督管理局上市许可。
【成大生物】b型流感嗜血杆菌结合疫苗进入Ⅲ期临床试验。
- The End -





 个人中心
个人中心
 我是园区
我是园区




