 Wnt信号通路是由配体Wnt和膜受体结合介导的一组多下游通道的信号转导途径。Wnt是一类分泌型糖蛋白,由酰基转移酶porcupine(PORCN)棕榈酰化后分泌,与细胞表面的卷曲蛋白受体家族(frizzled,FZD)以及脂蛋白受体相关蛋白5/6(lipoprotein receptor-related protein5/6,LRP5/6)共传递下游信号。这些通路可分为依赖于β-catenin的经典途径和不依赖于β-catenin的非经典途径。
与肿瘤进展显著相关的是依赖于β-catenin的经典途径,该信号级联的中心事件是对转录共激活因子β-catenin(β-连环蛋白)水解的正负双向调节。
Wnt信号通路是由配体Wnt和膜受体结合介导的一组多下游通道的信号转导途径。Wnt是一类分泌型糖蛋白,由酰基转移酶porcupine(PORCN)棕榈酰化后分泌,与细胞表面的卷曲蛋白受体家族(frizzled,FZD)以及脂蛋白受体相关蛋白5/6(lipoprotein receptor-related protein5/6,LRP5/6)共传递下游信号。这些通路可分为依赖于β-catenin的经典途径和不依赖于β-catenin的非经典途径。
与肿瘤进展显著相关的是依赖于β-catenin的经典途径,该信号级联的中心事件是对转录共激活因子β-catenin(β-连环蛋白)水解的正负双向调节。
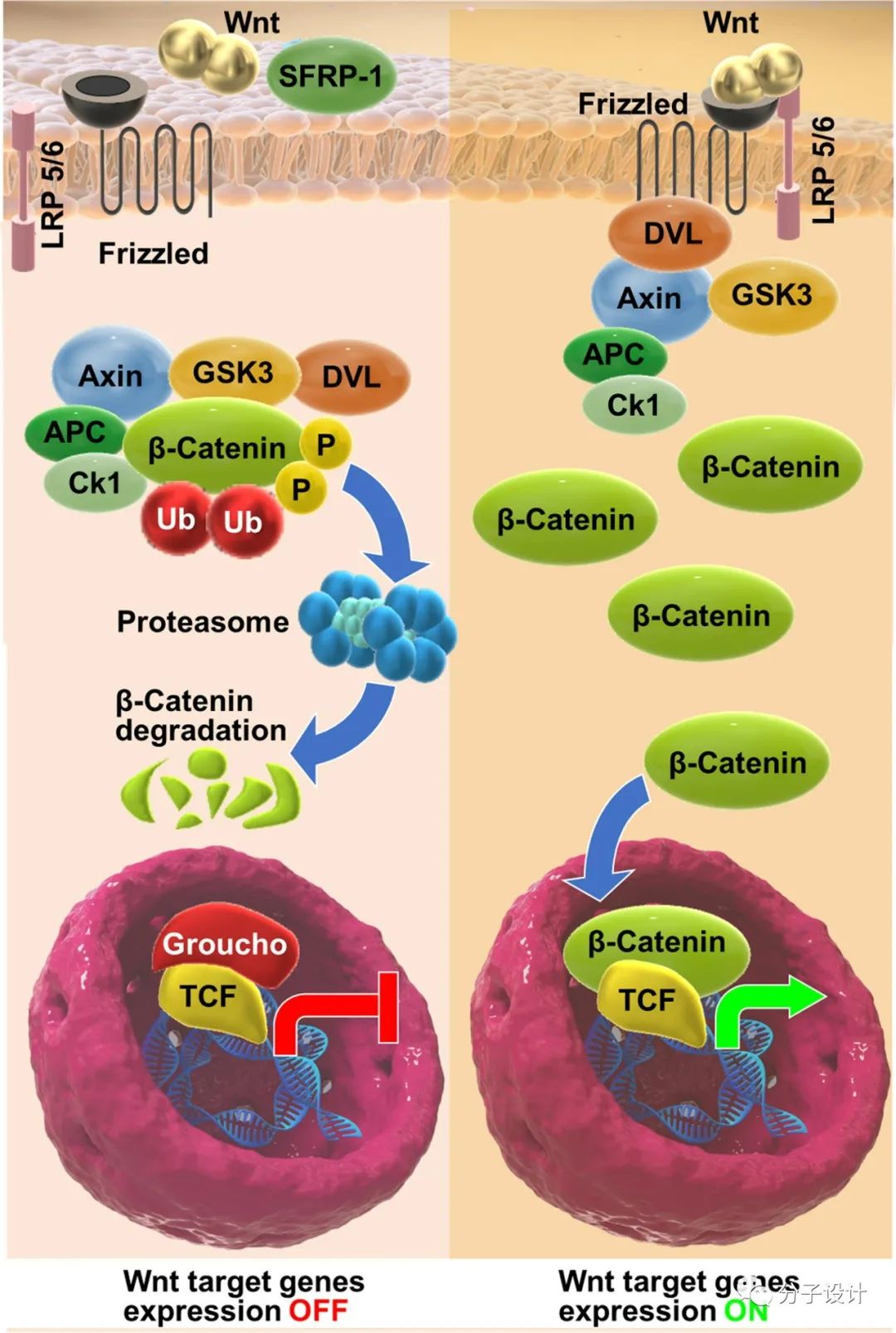
在没有Wnt信号的情况下,β-catenin被含有AXIN(一种支架蛋白)、APC(adenomatous polyposis coli,结肠腺瘤息肉易感蛋白)、CK1α(casein kinase 1α,酪蛋白激酶1α)、GSK3β(glycogen synthase kinase 3β,糖原合成酶激酶3β)的多亚基复合物结合并调节,这促进了β-catenin的磷酸化及其与β-TRCP(beta-transducin repeats-containing proteins,β-转导蛋白重复序列蛋白,一种E3泛素连接酶)的相互作用,导致β-catenin被泛素化降解,以维持细胞中β-catenin的低表达水平。Wnt存在情况下即激活状态时,Wnt结合FZD受体,导致LRP5/6磷酸化从而形成 WNT-FZD-LRP5/6 复合物,激活下游DVL蛋白(Dishevelled)并诱导多亚基复合物向受体聚集,DVL增强了对GSK3β的磷酸化和抑制作用,负调控多亚基复合物对β-catenin的降解作用。这促进了β-catenin的累积和核转位,与T细胞因子/淋巴样增强因子 (TCF/LEF)等共激活因子相互作用,激活Wnt下游的靶基因转录。
进入临床药名 |
适应证 |
作用机制 |
研发者 |
临床试验 |
XNW7201 |
晚期实体瘤 |
PORCN抑制剂 |
Sinovent |
NCT03901950 |
LGK974 PDR001 |
胰腺癌、BRAF突变型结直肠癌、黑色素瘤 |
PORCN抑制剂 |
Novartis |
NCT01351103 |
CGX1321 pembrolizumab |
实体瘤、胃肠道癌 |
PORCN抑制剂 |
Curegenix |
NCT02675946 |
RXC004 |
实体瘤 |
PORCN抑制剂 |
Redx Pharma Plc |
NCT03447470 |
ETC-1922159 pembrolizumab |
实体瘤 |
PORCN抑制剂 |
A*STAR Research Entities |
NCT02521844 |
SM08502 |
实体瘤 |
未知,抑制WNT通路相关基因表达 |
Samumed |
NCT03355066 |
Paclitaxel DKN-01 |
子宫内膜癌、 子宫癌、卵巢癌 |
DKK1单克隆抗体 |
Leap Therapeutics |
NCT03395080 |
DKN-01 sorafenib |
肝细胞癌 |
DKK1单克隆抗体 |
Leap Therapeutics |
NCT03645980 |
DKN-01 Paclitaxel pembrolizumab |
食道癌、 食管胃交界处腺癌 |
DKK1单克隆抗体 |
Leap Therapeutics |
NCT02013154 |
atezolizumab |
转移性食管癌胃癌 |
单克隆抗体 |
Royal Marsden NHS Foundation Trust |
NCT04166721 |
PRI-724 |
急性髓系白血病、慢性髓系白血病 |
β-catenin/CBP抑制剂 |
Prism Pharma |
NCT01606579 |
Foxy-5 |
结肠癌 |
WNT5A蛋白的模拟肽 |
WNT Research AB |
NCT03883802 |
Foxy-5 |
转移性乳腺癌、结直肠癌、前列腺癌 |
WNT5A蛋白的模拟肽 |
WNT Research AB |
NCT02020291 |
Foxy-5 |
转移性乳腺癌、结直肠癌、前列腺癌 |
WNT5A蛋白的模拟肽 |
WNT Research AB |
NCT02655952 |
SM08502 |
实体瘤 |
CDC样激酶抑制剂 |
Samumed |
NCT03355066 |
CWP232291 |
急性髓系白血病、慢性粒单核细胞白血病、骨髓增生异常综合征 |
β-catenin抑制剂 |
JW Pharmaceutical |
NCT01398462 |

2. DVL抑制剂
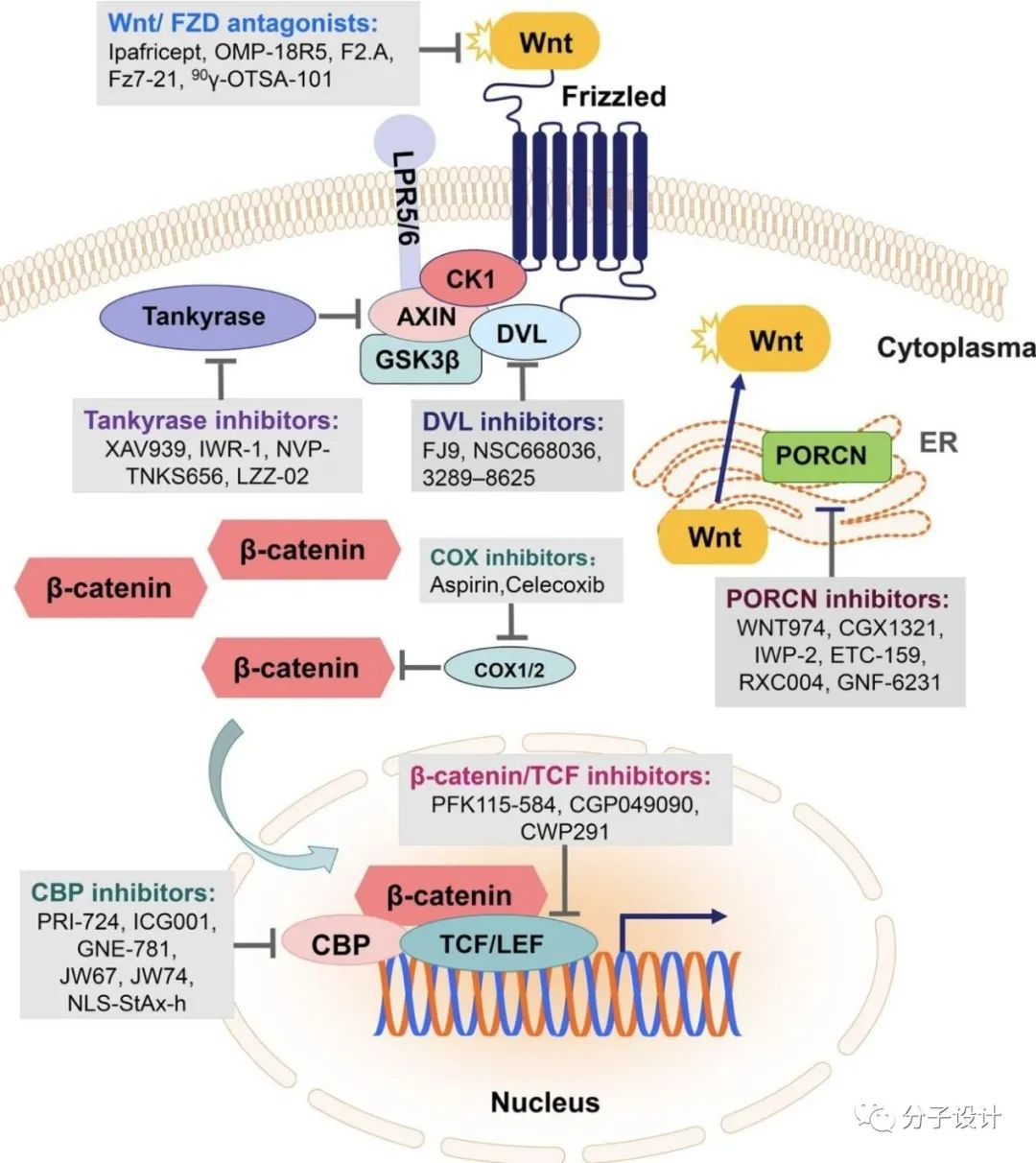
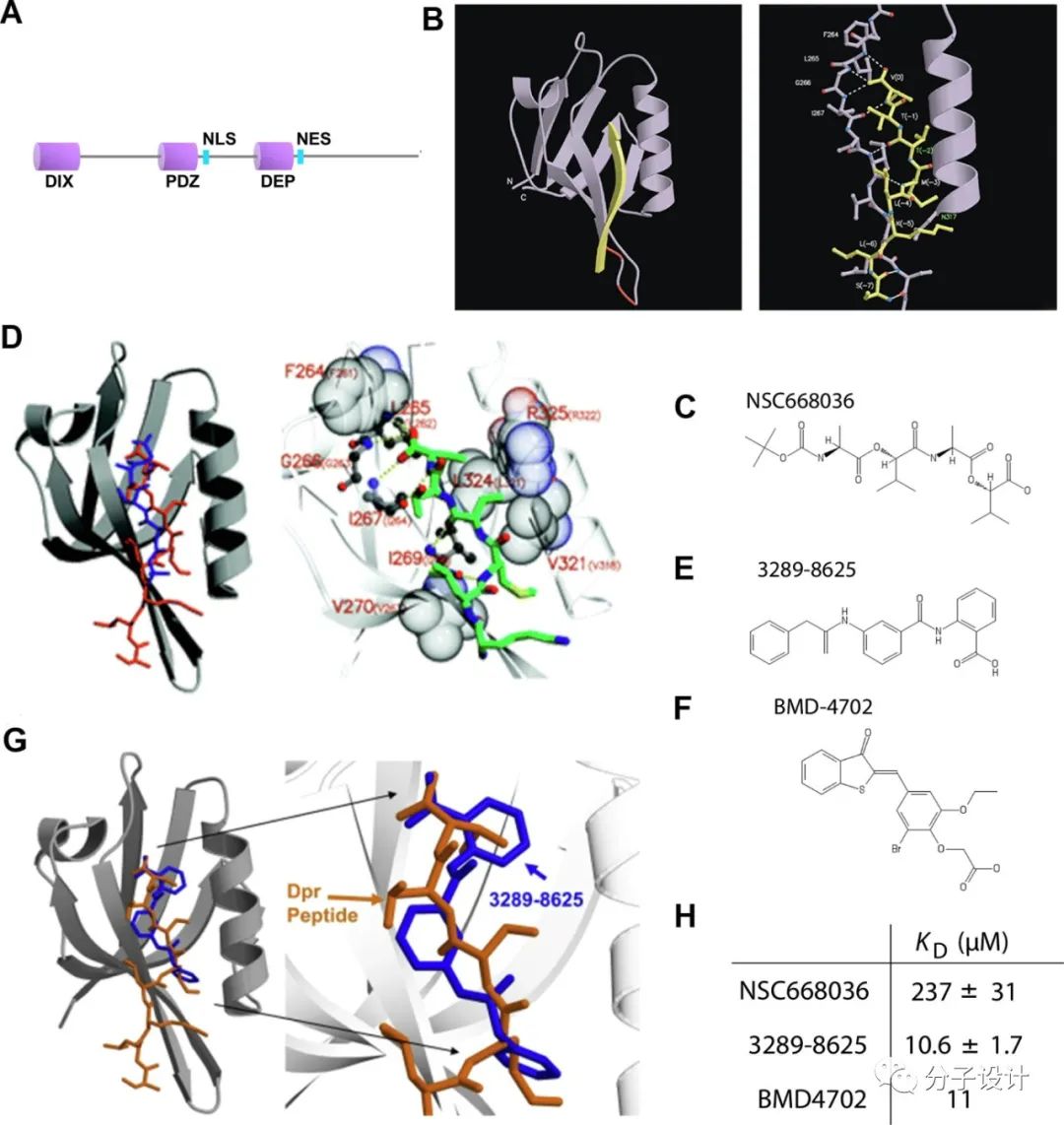
DVL通过将β-catenin破坏复合物的成分募集到细胞膜来影响Wnt信号传导。DVL 自身的C端结构域能与PDZ结构域发生分子内结合,处于“封闭状态”。而当Wnt激活后,DVL的PDZ结构域则与FZD蛋白的胞内羧基末端结合,触发下游信号传导。Dapper肽(SLKLMTTV)以及小分子NSC668036、BMD4702和 3289-8625以高亲和力结合DVL-PDZ, 阻断PDZ-FZD相互作用,抑制Wnt信号传导。NSC668036和3289-8625已被证实可下调 Wnt/β-catenin 信号传导并抑制肺癌、结肠直肠癌和宫颈癌细胞生长。DVL抑制剂虽然具有治疗潜力,但对DVL下游的大多数突变(如APC突变)可能无效。此外,PDZ结构域蛋白广泛分布,涉及了其他各种信号通路,使得开发靶向Wnt通路的特异性抑制剂具有挑战性。
(二)靶向降解 β-catenin的多亚基复合物
1. AXIN稳定剂(端锚聚合酶抑制剂)
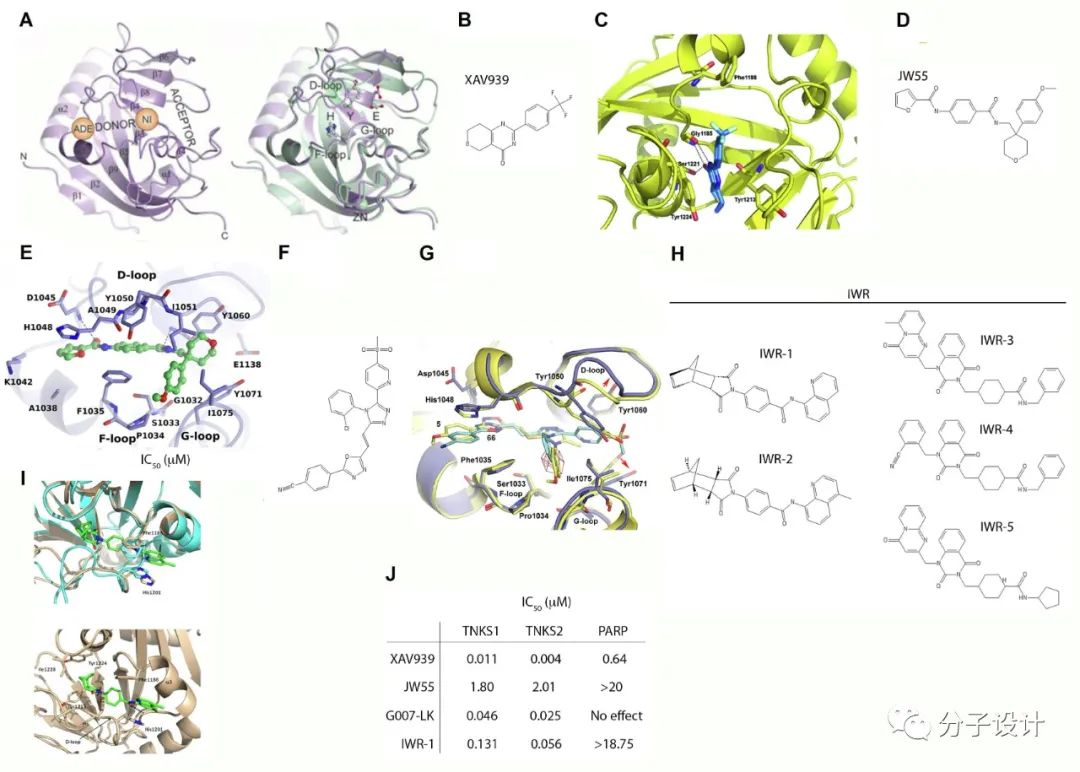
支架蛋白AXIN是β-catenin破坏复合物的重要组分,受到端锚聚合酶(tankyrase,TANKS)调控。端锚聚合酶通过泛素-蛋白酶体途径来调节AXIN1和AXIN2的稳定性。而TANKS抑制剂通过稳定AXIN下调β-catenin信号传导。小分子化合物XAV939是结直肠癌细胞系中wnt信号传导的有效抑制剂, 与TANKS1和TANKS2的共晶体结构表明,XAV939竞争结合于PARP结构域中的NAD+结合口袋,这种相互作用涉及的氨基酸残基在所有PARP域中都是保守的,因此不能证明XAV939对端锚聚合酶的特异性。另一组抑制剂JW55及其类似物也通过靶向TANKS1/2来抑制结肠癌细胞和肠腺瘤小鼠模型中的wnt信号传导。G007-LK和G244-LM是两种更稳定高效的端锚聚合酶抑制剂,已被证明在结直肠癌小鼠异种移植模型中有效。除了上述竞争性抑制剂,IWRs通过对TANKS1的变构作用结合于新的变构位点。
2. CK1激动剂

FDA批准的药物pyrvinium能选择性地增强CK1α激酶活性,具有APC突变的结肠癌细胞对pyrvinium治疗敏感,wnt信号传导下调。另外,一种名为SSTC3的新型CK1α小分子激动剂已被证明可抑制小鼠结直肠癌异种移植物的生长。
(三)靶向 β-catenin/TCF 转录复合物

β-catenin/TCF复合物转录激活靶基因是经典Wnt信号通路的最后环节,理论上只阻断这一步可以减轻由于调节其他上游目标产生的副作用。小分子PNU-74654可与TCF4 竞争结合β-catenin,类似地,抑制剂iCRT与β-catenin上的TCF 结合位点相互作用,在小鼠结肠癌模型中表现出抗肿瘤作用。PFK115-584 和 CGP049090以剂量依赖性方式阻断β-catenin/TCF复合物。β-catenin依赖性转录程序有多种共激活因子,包括cAMP反应元件结合蛋白(CBP),小分子抑制剂ICG-001特异性结合CBP,阻断转录复合物的形成,在神经胶质瘤,结肠癌中有治疗潜力。PRI-724也可以抑制β-catenin和CBP相互作用,增加上皮性卵巢癌对化疗药物的敏感性。除此以外,最近报道了一种新的β-catenin抑制剂,称为C2,结合于β-catenin的一个隐式变构位点,抑制β-catenin的致瘤能力。β-catenin及转录复合物的抑制剂针对Wnt通路下游效应子,在各种发生上游突变的肿瘤类型中具有更广泛的治疗潜力。
(四)靶向WNT/β-catenin通路的新策略
发生不同类型wnt通路突变的癌症需要更加特异性,精准化的靶向治疗,来减少副作用。所以挖掘新型药物分子靶标是优化癌症精准医疗的重要手段。
1. 靶向DVL-AXIN
DVL可通过DIX结构域和AXIN的DAX结构域形成异源复合物,DAX-DIX接触界面形成的疏水相互作用和氢键等作用,为开发小分子药物提供结构基础。还需要进一步揭示DVL-AXIN相互作用的动态过程,结合蛋白-蛋白相互作用(protein-protein interaction,PPI)的药物研究,精准设计有效的抑制剂。
2. 靶向相分离凝聚体
WNT/β-catenin通路中的蛋白复合物异常相分离与癌症密切相关,为更好地理解蛋白复合物如何形成功能性凝聚体,以及小分子药物如何正确分布到凝聚体中,还需要更多相分离,蛋白质组学,AI辅助药物设计等相关研究。
3. 靶向β-catenin磷酸化位点和核转运
β-catenin被多亚基复合物磷酸化,不同的磷酸化位点在正常发育和疾病发生中的作用尚未明确。不同磷酸化形式的调节及其与各种疾病,尤其是癌症的关系,需要进一步研究,可能会启发一些新的治疗方法。此外,β-catenin有自身独特的核转运机制,有希望作为癌症治疗干预的新方向。最近,MAPK相互作用激酶 (MAPK-interacting kinase,MNK1) 的抑制剂CGP57380 也显示出抑制β-catenin的核易位,减弱了鼻咽癌细胞的迁移侵袭能力。
(五)靶向WNT/β-catenin通路的研究机遇和挑战
许多天然产物来源的生物活性化合物可通过调节经典Wnt信号通路发挥抗肿瘤作用。比如从姜黄根茎中分离出的姜黄素可调节Wnt通路并在黑色素瘤、肺癌、乳腺癌、结肠癌等癌症中发挥治疗作用。汉黄芩素是一种从黄芩中分离出的黄酮类化合物,可降低细胞内Wnt蛋白水平并激活降解β-catenin。天然产物是药物发现的宝库。尽管Wnt/β-catenin靶向治疗多种多样,并取得一定进展,但仍存在诸多挑战,脱靶效应、毒副作用不容忽视。Wnt/β-catenin信号在正常发育中的重要作用使得靶向药物引起在骨骼、毛发、胃肠道和造血中的毒性作用,限制了临床应用。因此,需要进一步探索特异性靶向或组合靶向WNT/β-catenin 通路的新方法。而WNT/β-catenin通路(19 个配体和超过15个受体)分子相互作用的复杂性及其参与不同的生理功能使得药物发现具有挑战性,以人工智能为代表的新技术的引入,通过利用自然语言处理、深度学习、机器学习和图像识别等,极大地提高药物研发的效率和成功率。
参考文献
1. Chatterjee, Avradip et al. “Advances in targeting the WNT/β-catenin signaling pathway in cancer.” Drug discovery today, S1359-6446(21)00317-2. 10 Jul. 2021




 个人中心
个人中心
 我是园区
我是园区




