又一项里程碑!传奇生物 CAR-T 在欧盟获批上市
收藏
关键词:
上市生物CAR获批
资讯来源:Insight数据库 + 订阅账号
发布时间:
2022-05-26
5 月 26 日,传奇生物宣布欧盟委员会(EC)已授予 CARVYKTI®(西达基奥仑赛,英文通用名 Ciltacabtagene Autoleucel,简称 Cilta-cel)附条件上市许可,用于治疗既往接受过至少三种治疗,包括免疫调节药物、蛋白酶体抑制剂和抗 CD38 抗体,并且末次治疗出现疾病进展的复发或难治性多发性骨髓瘤(R/R MM)成人
患者。
西达基奥仑赛是一款 BCMA 靶向 CAR-T 细胞疗法,传奇生物与强生在 2017 年 12 月达成了全球独家许可和合作协议,
以开发和商业化 Cilta-cel。今年 2 月 28 日,西达基奥仑赛获 FDA 批准在美国上市,不仅是传奇生物的一大里程碑,也是国内创新药出海的重要里程碑;今日,西达基奥仑赛再下一城,在欧盟也成功获批上市。
西达基奥仑赛在欧美的获批均是基于关键性临床 1b/2 期 CARTITUDE-1 研究结果。结果表明,在单次治疗复发或难治性多发性骨髓瘤患者中,西达基奥仑赛显示出高达 98% 的总缓解率 (ORR)。
此前该药在美国获批上市时定价为 46.5 万美元,暂未知在欧洲的定价。
四年前的 2017 年,西达基奥仑赛在美国临床肿瘤学会年会(ASCO)上首次亮相,便以优异的疗效数据一鸣惊人。2017 年可谓是 CAR-T 疗法上市元年,在那一年诺华的 Kymriah、吉利德的 Yescarta 先后获批上市,走向市场。而 Yescarta 是吉利德科学斥资 119 亿美元收购的 Kite Pharma 而获得的产品,交易金额之高曾引起行业轰动。
2017 年 12 月,强生子公司 Janssen 与传奇生物签订了独家全球许可和合作协议,以开发和商业化西达基奥仑赛
,这笔交易仅预付款就高达 3.5 亿美元,在当时国内 license-out 授权中排名前列。在美国,两家公司的权益按 50:50 分成。不仅授权交易方面,西达基奥仑赛还取得多项成绩,国内 CDE 在突破性疗法程序发布之后,首个突破性疗法认定就颁给了它,FDA 也授予了多项资格认定。
2020 年 12 月 21 日,杨森宣布开始向 FDA 滚动提交西达基奥仑赛用于治疗复发和/或难治性多发性骨髓瘤成年人的生物制品上市申请(BLA)。
这项申请
基于关键性
lb/2
期
CARTITUDE-1
研究的结果,该研究评估了
ciltacel
在治疗复发和
╱
或难治性多发性骨
髓瘤患者中的有效性和安全性。
CARTITUDE-1 研究
纳入了既往接受过中位六线治疗(范围 3-18)
包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)和抗 CD38 抗体的患者。
结果显示,在中位随访 18 个月(范围 1.5-30.5)中,97 例接受西达基奥仑赛一次性治疗的 R/R MM 患者出现了早期、深度持久的缓解,
总缓解率(ORR)高达 98%(95%CI:92.7-99.7)。
80% 的患者达到了严格意义的完全缓解(sCR),即治疗后无法通过影像学或其他检查观察到任何疾病体征或症状的措施。
在两项入组的 179 名成人患者的开放标签临床试验(MMY2001 和 MMY2003)中,评估了西达基奥仑赛的安全性。最常见的不良反应 (≥20%) 为中性粒细胞减少症 (91%)、细胞因子释放综合征 (CRS) (88%)、发热 (88%)、血小板减少症 (73%)、贫血 (72%)、白细胞减少症 (54%) 等。
在即将举行的 2022 ASCO 大会中,传奇生物还将公布 CARTITUDE-1 研究的长期(最后一例患者入组后两年)随访结果
,以及 CARTITUDE-2 研究队列 A 和 B 的更新材料,涉及西达基奥仑赛在多发性骨髓瘤各种治疗场景(包括前线治疗)中的安全性和有效性。其中队列 B 入组人群初治后出现早期复发的患者,预计明日其摘要就将披露。
值得一提的是,目前已上市和在研的 CAR-T 疗法在 CD19 靶点上扎堆较为严重。BCMA 次之,但竞争相对更轻。
目前,全球范围内仅 BMS 子公司蓝鸟生物研发的 BCMA 靶向 CAR-T 抢先在 2021 年 3 月末获批,Abecma(ide-cel)首年销售成绩已经出炉,高达 1.64 亿美元,约为同期获批的 CAR-T 产品的两倍之高,这也体现了该类疗法在多发性骨髓瘤治疗领域的潜在前景。
2021 年度,在美国已获批上市的 5 款 CAR-T 疗法合计销售额已经超过了 15 亿美元,且同比增幅均超过 20%,还将继续保持高速增长。
而传奇生物不仅在全球方面和强生合作向美国 FDA、欧盟 EMA、日本 PMDA 都递交了上市申请,在中国也即将申报上市。
根据此前企业披露的信息,计划于 2022 年初向 CDE 提交上市申请。
根据传奇生物去年 10 月研发日公布的临床开发计划,后续还将开展针对更前线治疗的临床试验。事实上,CARTITUDE-4 和 CARTITUDE-5 两项全球多中心 III 期临床目前都已经启动
。
西达基奥仑赛(Cilta-cel)多发性骨髓瘤开发计划
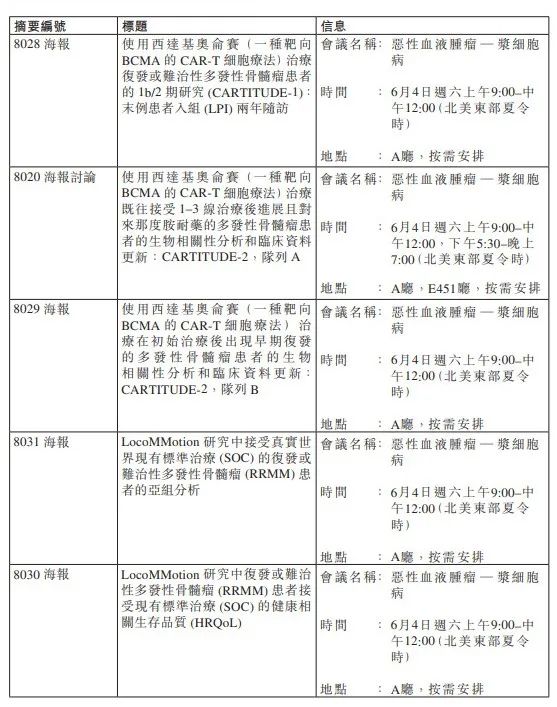
Insight 数据库
显示,目前西达基奥仑赛在全球共登记了 15 项临床试验,包括 3 项 III 期临床(如图),其中 CARTITUDE-5(NCT04923893)为一线疗法。前线疗法的拓展对于后续产品销售无疑将产生积极影响,而强生/传奇在获批上市之前已经开始了这方面的探索。

http://db.dxy.cn/v5/home/
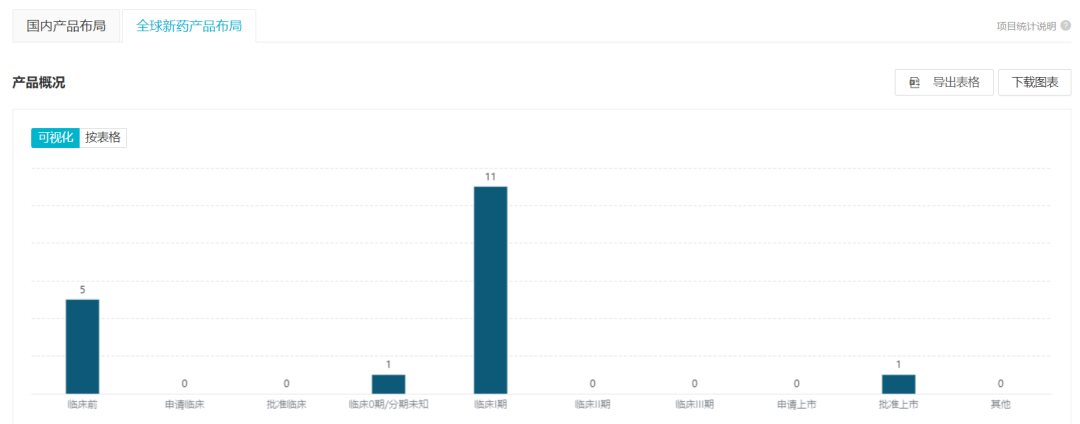
根据 Insight 数据库 企业分析模块数据
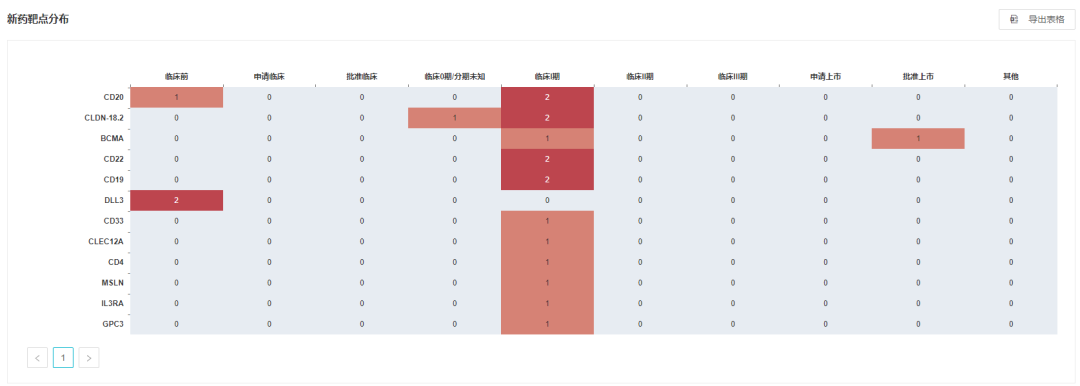
,当前传奇生物共 16 款细胞疗法产品在研,除了进度最快的西达基奥仑赛之外,11 款已经处于临床 I 期。不光包括 CAR-T 疗法,还包括 TCR-T、CAR-NK。靶点方面,6 个靶点有超过 1 款产品布局。
http://db.dxy.cn/v5/home/
国内 CAR-T 疗法竞争者众多已经是众所周知的事情,从临床试验数而言甚至占到了全球的一半以上。仅论 BCMA 靶点,信达生物与驯鹿合作的伊基仑赛(IBI326)也即将在今年年内申报上市,优卡迪的 BCMA 靶向 CAR-T 也进入了 III 期临床,科济生物的 CT053 则处于 II/III 期临床开发阶段。国内目前尚无 BCMA 靶向 CAR-T 细胞疗法申报上市,谁将抢得先手?
根据 Insight 数据库 企业分析模块筛选可以看到,以管线内全为创新药、且 CAR-T + CAR-NK + TCR-T 疗法占比超过 80%、细胞疗法项目数超过 12 的企业作为该领域的重点关注企业,共 15 家企业满足要求,详见下图。
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn












 药选址
药选址










