12 月 9 日,腾盛博药宣布,其新冠单克隆中和抗体安巴韦单抗/罗米司韦单抗联合疗法(此前称 BRII-196/BRII-198 联合疗法)获中国药品监督管理局(NMPA)的上市批准,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12-17 岁,体重≥40 kg)新型冠状病毒感染( COVID-19)患者。其中,青少年(12-17 岁,体重≥40 kg)适应症人群为附条件批准。
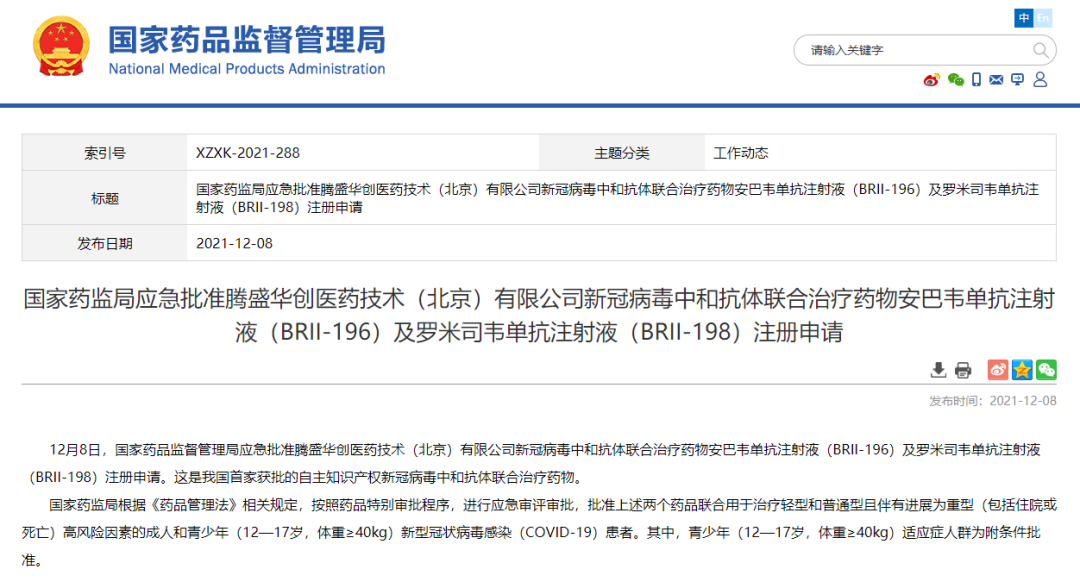
来自:NMPA 官网
此次获批是基于美国国立卫生研究院(NIH)支持的 ACTIV-2 的 3 期临床试验,包括 847 例入组患者的积极中期及最终结果。最终结果显示,与安慰剂相比,安巴韦单抗/罗米司韦单抗联合疗法使临床进展高风险的新冠门诊患者住院和死亡风险降低 80%(中期结果为 78%),具有统计学显著性。
截至 28 天的临床终点,治疗组为零死亡而安慰剂组有 9 例死亡,并且其临床安全性优于安慰剂组。同时,无论早期即开始接受治疗(症状出现后 5 天内)还是晚期才开始接受治疗(症状出现后 6 至 10 天内)的受试者,住院和死亡率均显著降低,这为新冠患者提供了更长的治疗窗口期。
仅不到 20 个月的时间,腾盛博药就将安巴韦单抗/罗米司韦单抗联合疗法从最初的实验室研究迅速推进到完成国际 3 期临床试验,并最终获得中国的上市批准。
安巴韦单抗和罗米司韦单抗是腾盛博药与深圳市第三人民医院和清华大学合作从新型冠状病毒肺炎(COVID-19)康复期患者中获得的非竞争性新型严重急性呼吸系统综合症病毒 2(SARS-CoV-2)单克隆中和抗体,特别应用了生物工程技术以降低抗体介导依赖性增强作用的风险,并延长血浆半衰期以获得更持久的治疗效果。
2021 年 10 月,腾盛博药已完成向美国食品药品监督管理局(FDA)提交安巴韦单抗/罗米司韦单抗联合疗法的紧急使用授权 (EUA)申请。
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
编辑:加一
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
点击卡片进入 Insight 小程序
药品申报、临床、上市、一致性评价…
随时随地查!
↓↓ 点击解锁更多新功能



 个人中心
个人中心
 我是园区
我是园区




