速递!健信生物抗PD-1/TIM3双抗在中国获批临床
收藏
关键词:
获批临床
资讯来源:医药观澜 + 订阅账号
发布时间:
2022-02-11
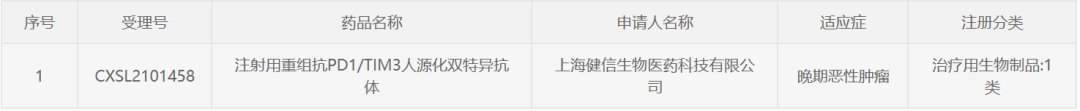
近日,上海健信生物医药科技有限公司(下称:
健信生物)宣布,其自主研发的序列特异IgG-like双特异抗体(SBody)平台产品Bis5,获得中国国家药品监督管理局药品审评中心(CDE)临床试验默示许可,拟用于晚期恶性肿瘤。
根据新闻稿,Bis5是一款注射用重组抗PD-1/TIM3人源化双特异抗体,此前已在美国获批临床。
健信生物创立于2015年,是一家专注双特异抗体和多特异抗体新药研发的高新技术公司。健信生物定位于肿瘤免疫治疗细分领域的前沿创新,聚焦产品,解决PD-1抑制剂治疗无效和耐药的细分人群的临床刚需。
Bis5是一款创新PD-1/TIM3对称二价双抗产品。
PD-1是程序性细胞死亡受体,PD-1/PD-L1信号通路在肿瘤免疫的逃逸中扮演着重要角色。TIM3是一类T细胞表面抑制性分子,能够引起癌症与慢性病毒感染过程中T细胞衰竭,对肿瘤细胞杀伤过程中起到重要作用,是肿瘤免疫治疗的有效靶点。
据新闻稿介绍,Bis5序列为特异对称结构,针对双靶点具有同等亲和力,且具有DC细胞、NK细胞、T细胞活性。该产品拟用于抗PD-1抗体治疗无效和耐药的肺癌、食管癌、结直肠癌等肿瘤患者,以及因肿瘤微环境抑制、先天免疫细胞活性不足、T细胞耗竭等原因引起的无效和或耐药的细分人群。临床前药效研究显示,针对PD-1抑制剂单药,以及PD-1抑制剂与TIM3单抗联用均无效的肿瘤,Bis5显示出显著抑制肿瘤和延迟生存期的效果。
此次Bis5在中国获批临床,拟开发用于晚期恶性肿瘤。新闻稿表示,该产品将于近期在中国启动临床试验。
[1]中国国家药监局药品审评中心(CDE)官网. Retrieved Feb 11,2022. From https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026d
[2]
喜报 | 健信生物Bis5获得NMPA临床试验默示许可!.Retrieved Feb 9,2022. From
https://mp.weixin.qq.com/s/MIG4aU1WUv8zKyNZIy_PrA
本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。



 药选址
药选址
