▎药明康德内容团队报道
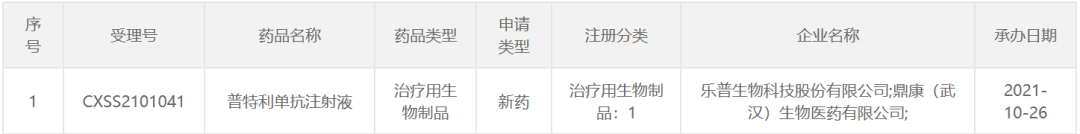
10月26日,中国国家药监局药品审评中心(CDE)最新公示显示,乐普生物已递交其核心产品普特利单抗注射液的第二项适应症上市申请,并获得受理。根据乐普生物公开资料,此次递交的适应症为:用于治疗卫星不稳定(MSI-H)/错配修复功能缺陷(dMMR)实体瘤。此前,该产品已于今年7月
递交
二线治疗黑色素瘤的上市申请。
公开资料显示,普特利单抗(pucotenlimab,HX008)是通过使用人IgG4亚型针对人PD-1的人源化单抗。它可拮抗PD-1信号,以通过阻断PD-1与其配体PD-L1及PD-L2的结合来恢复免疫细胞杀死癌细胞的能力。同时,普特利单抗创新性地采用抗体工程技术,于Fc区引入突变,提高FcRn的结合亲和力,从而大幅延长其半衰期,以期提高患者的临床疗效及药物依从性。
根据一项在MSI-H/dMMR晚期实体瘤中开展的关键性2期临床研究结果,普特利单抗在单药治疗的情况下具有良好的疗效和安全性。截止到2021年6月3日,该试验临床总响应率(ORR)为46.0%,疾病控制率(DCR)为70.0%,中位无进展生存期(mPFS)尚未达到,12个月无进展生存比例为55.1%。中位总生存期(OS)尚未达到,6个月、9个月、12个月的OS率分别为86.0%、79.4%和76.6%。
MSI-H与dMMR是两种常见的遗传异常,含有这两种变异的肿瘤,细胞内的DNA修复机制往往会受到影响,不能正常发挥作用。带有这些异常的肿瘤分布非常广泛,可出现在结直肠、子宫内膜、胃肠道、乳腺、前列腺、膀胱、甲状腺等多个部位。因此,通过遗传变异特征而非病发部位来区分这些癌症,对于治疗有着一定指导意义。
除了MSI-H/dMMR实体瘤和黑色素瘤,普特利单抗还在开展多项临床试验。
根据中国药物临床试验登记与信息公示平台,目前
普特利单抗正在开展的
临床试验包括胃癌或胃食管结合部癌二线治疗的3期临床试验、非小细胞肺癌(NSCLC)的2/3期临床试验,以及分别针对三阴性乳腺癌(TNBC)、甲状腺未分化癌、肝细胞癌(HCC)等适应症的2期临床试验等。
参考资料:
[1]中国国家药监局药品审评中心官网. Retrieved Oct 26,2021, from https://www.cde.org.cn/main/xxgk/listpage/9f9c74c73e0f8f56a8bfbc646055026[
[2]乐普生物PD-1申报第2项适应症:MSI-H实体瘤 . Retrieved Oct 26,2021, from https://mp.weixin.qq.com/s/taC9Q2DRBroQhrjQNeYOHA
本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。






 个人中心
个人中心
 我是园区
我是园区




