标的公司:Bristol Myers Squibb (NYSE:BMY)
百时美施贵宝(NYSE:BMY)宣布,美国食品和药物管理局(FDA)批准Zeposia® (ozanimod/0.92mg),用于治疗成人中度至重度活动性溃疡性结肠炎(UC),一种慢性炎症性肠病(IBD)。Zeposia,是目前唯一批准用于中度至重度活动性UC患者的1-磷酸鞘氨醇(S1P)受体调节剂。

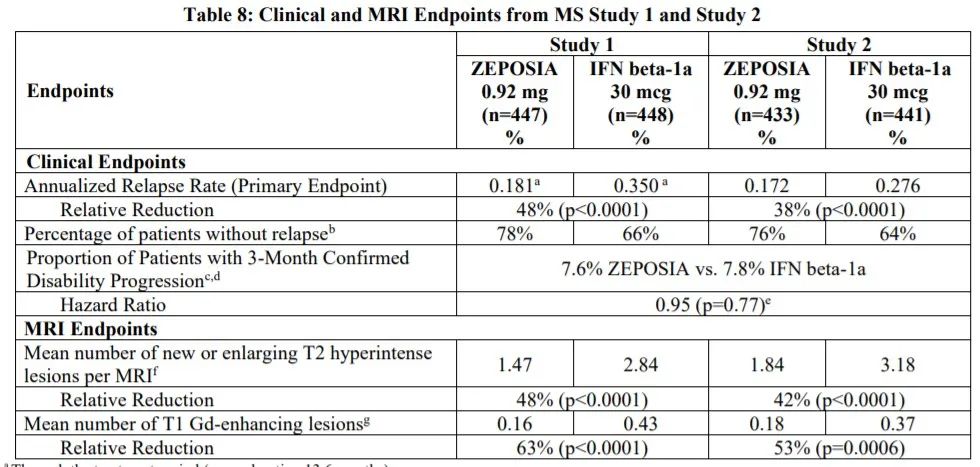
这项批准是基于来自关键III期试验True North的数据,评估Zeposia作为诱导和维持疗法与安慰剂对中度至重度活动性UC成年患者的疗效。
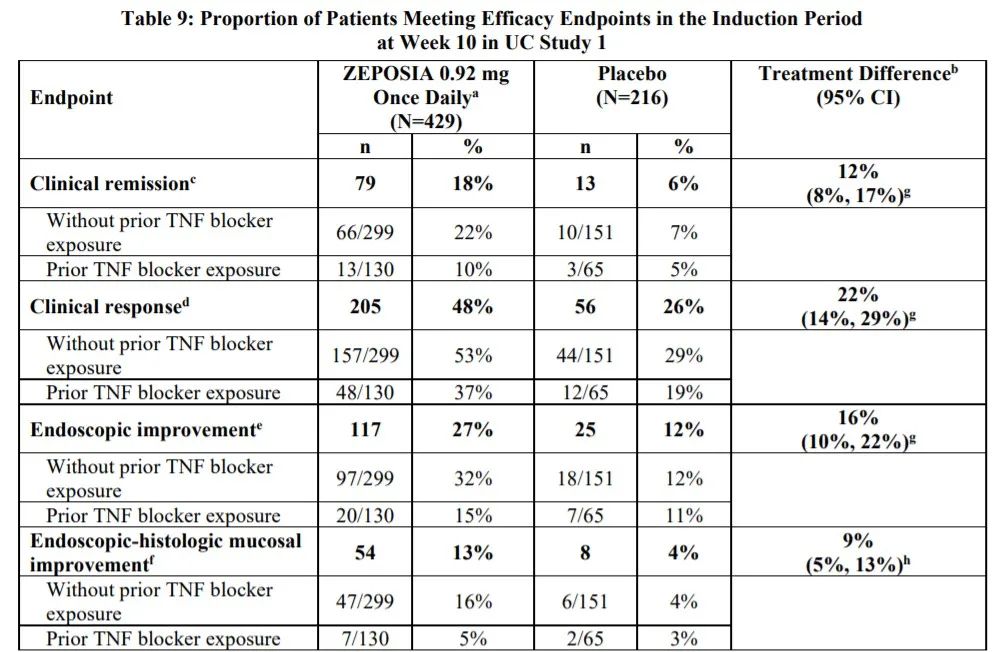
在第10周诱导期间(Zeposia N=429 vs. placebo N=216),试验达到了临床缓解的主要终点(18%vs 6%, p<0.0001)以及主要次要终点,包括临床反应(48%vs 26%,p<0.0001)、内镜改善(27% vs 12%,p<0.0001),Zeposia组和安慰剂组的内镜-组织学粘膜改善率分别为13% vs.4%,(p<0.001)。
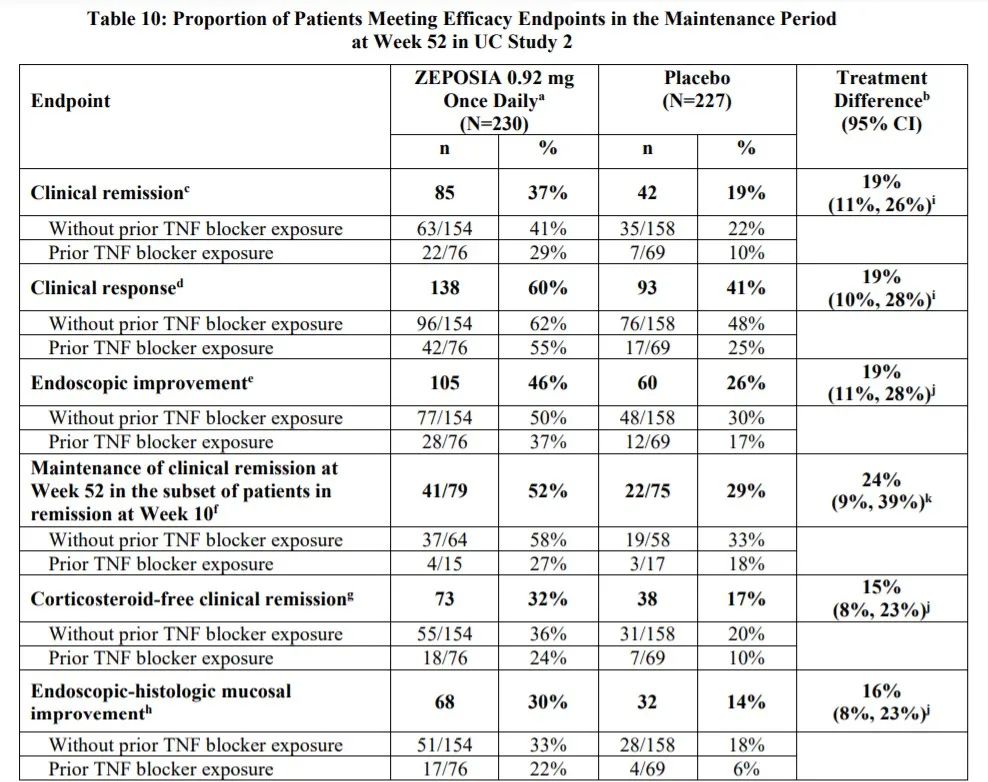
在第52周的维持期间(Zeposia N=230 vs placebo N=22),试验达到了临床缓解的主要终点(37% vs.19%,p<0.0001)以及关键的次要终点,包括临床反应(60% vs.41%,p<0.0001)、内镜改善(46%vs. 26%,p<0.001)、无皮质类固醇临床缓解(32% vs. 17%),Zeposia组和安慰剂组的粘膜-组织学改善率分别为30%和14%(p<0.001)。
在接受Zeposia治疗的患者中,早在第2周(即完成所需7天剂量后1周)就观察到直肠出血和大便次数分项得分的减少。
Zeposia 的禁忌症包括过去6个月内经历过心肌梗死、不稳定型心绞痛、中风、短暂性脑缺血发作(TIA)、需要住院治疗的失代偿性心力衰竭、III/IV级心力衰竭或存在MobitzII型二度或三度房室传导阻滞,病态窦房结综合征,或窦房传导阻滞,除非患者有功能性起搏器;严重未经治疗的睡眠呼吸暂停患者;以及服用单胺氧化酶(MAO)抑制剂的患者。Zeposia与以下警告和预防措施相关:感染风险增加、心律失常缓慢和房室传导延迟、肝损伤、胎儿风险、血压升高、呼吸影响、黄斑水肿、后可逆性脑病综合征(PRES),先前的免疫抑制或免疫调节药物产生的非预期的加性免疫抑制作用,以及停止玉米赤霉病后残疾和免疫系统影响的严重增加。最常见的不良反应(发生率≥4%)为肝功能亢进、上呼吸道感染、头痛。
True North
True North是一项3期、多中心、随机、双盲、安慰剂对照临床试验,评估Zeposia®(ozanimod/0.92mg) 的疗效和安全性,用于中度至重度活动性溃疡性结肠炎患者,这些患者对以下任何一种药物反应不足或不耐受:口服氨基水杨酸盐、皮质类固醇、免疫调节剂等。在诱导期之前和期间,患者将接受口服氨基水杨酸盐和/或皮质类固醇的治疗。共有30%的患者曾失败或对TNF阻滞剂不耐受。在这些患者中,63%的患者至少接受了两种治疗,包括肿瘤坏死因子阻滞剂。研究开始时,平均年龄42岁,60%为男性,平均病程7年。在为期10周的诱导研究(UC研究1)中,共有645名患者按2:1的比例随机接受Zeposia(N=429)或安慰剂(N=216),其中94%和89%的患者完成了诱导研究。
在维持治疗(UC研究2)中,共有457名在UC研究1或开放标签组中接受Zeposia治疗并在第10周达到临床疗效的患者按1:1重新随机分组,并接受Zeposia 0.92 mg(N=230)或安慰剂(N=227)治疗42周,在总共52周的治疗中,合用氨基水杨酸盐在52周内保持稳定。合用皮质类固醇的患者在进入维持性研究后减少剂量。其中,分别有80%和54.6%接受Zeposia和安慰剂的患者完成了研究。
所有符合条件的患者都被纳入了一项开放标签扩展试验,该试验正在进行中,旨在评估Zeposia治疗中度至重度活动性溃疡性结肠炎的长期疗效。
关于溃疡性结肠炎
溃疡性结肠炎(UC)是一种慢性炎症性肠病(IBD),其特征是不规则的慢性免疫反应,在大肠(结肠)或直肠的粘膜(衬里)产生炎症和溃疡(溃疡)。症状包括血便,严重腹泻和频繁腹痛。许多患者对现有治疗反应不足或根本没有反应。截至2015年,据估计,美国约有300万成人患有IBD,包括UC和克罗恩病 (CD)。
Zeposia® (ozanimod)
Zeposia ® (ozanimod)是一种口服的1-磷酸鞘氨醇(S1P)受体调节剂,与S1P受体1和5具有高亲和力。Zeposia 降低淋巴细胞从淋巴组织迁移的能力,减少外周血中循环淋巴细胞的数量。目前对溃疡性结肠炎的治疗作用机制尚不清楚,但可能涉及减少淋巴细胞向肠道的迁移。
百时美施贵宝公司继续在一项开放性扩展试验中评估Zeposia,该试验正在进行中,旨在评估Zeposia治疗中重度活动性溃疡性结肠炎的长期疗效。以及一项III期YELLOWSTONE临床试验项目中研究Zeposia对中度至重度活动性克罗恩病的治疗作用。

Zeposia于2020年3月被美国食品和药物管理局(FDA)批准用于治疗成人复发型多发性硬化症(RMS)。2020年5月欧盟委员会(EC)批准Zeposia用于治疗成人复发缓解型多发性硬化症(RRMS)伴临床或影像学活动性疾病。欧洲药品管理局(EMA)目前正在审查Zeposia用于治疗成人中度至重度活动性UC的营销授权申请(MAA)。预计将在2021年下半年作出决定。



 个人中心
个人中心
 我是园区
我是园区




