
ACLX-001是一款自体、基因编辑的T细胞疗法,基于该公司专有平台ARC-SparX开发。ACLX-001由一个抗原受体复合物T细胞(ARC-T细胞)和SparX蛋白组成,ARC-T细胞是一种通用的细胞,不具有靶向性;靶向性由SparX蛋白控制。ACLX-001被设计靶向BCMA,被开发用于治疗复发/难治性多发性骨髓瘤成人患者。
▲ ARC-SparX平台(图片来源:Arcellx)
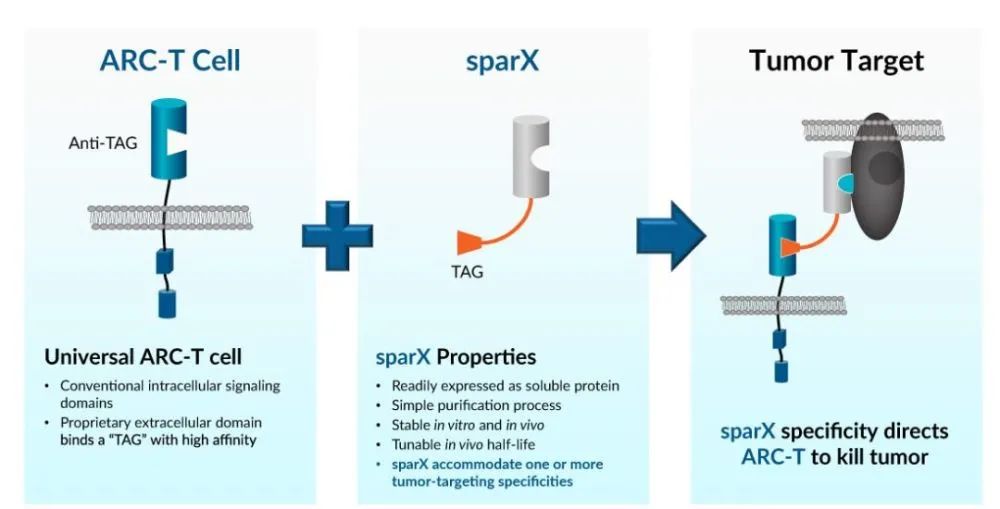
Arcellx的ARC-SparX平台有两个关键组成部分:ARC-T细胞和SparX蛋白。
ARC-T细胞是结合SparX蛋白的工程免疫细胞,具有一个结构域可以与SparX蛋白上的通用Tag结合,只有当SparX蛋白存在时,ARC-T细胞才能识别并杀伤肿瘤细胞,否则不具备靶向能力和肿瘤杀伤能力。
SparX蛋白由一个结合域和Tag组成,结合域能够被设计靶向不同的抗原,可以针对不同疾病类型选择不同靶标;Tag负责结合ARC-T细胞,将ARC-T细胞募集到靶向识别的细胞附近,对目标细胞进行杀伤。
这种模块化的工程平台,可以通过调整SparX蛋白的剂量,从而管理和控制ARC-T细胞的活性,具有可控的安全性。同时,利用SparX蛋白的可变性,可以对靶点丢失的复发患者进行治疗。

据报道,FDA对ACLX-001的IND批准得到了另一款候选产品CART-ddBCMA临床数据的支持,CART-ddBCMA与ACLX-001使用相同的BCMA定向结合域。2020年美国血液学会会议上(ASH),该公司公布了前6名接受CART-ddBCMA治疗的患者的临床数据。数据显示:按照IMWG标准,6例多发性骨髓瘤患者都产生应答,其中有4例达到了严格的完全缓解。该疗法还具有良好的耐受性。
Arcellx董事长兼首席执行官Rami Elghandour表示:“在我们第一阶段临床试验中,证明了我们的新型结合域技术在多发性骨髓瘤患者中的临床意义,ACLX-001是我们技术平台的下一步差异化验证。“
参考资料:
1.https://www.biospace.com/article/releases/arcellx-announces-fda-clearance-of-ind-application-for-aclx-001-a-controllable-cell-therapy-utilizing-the-company-s-arc-sparx-platform-for-the-treatment-of-multiple-myeloma-/
2. 宜明细胞生物《细胞疗法新动向:Arcellx 的“可控”细胞疗法治疗晚期多发性骨髓瘤获批IND》
3.深圳市奥祺生物有限公司《FDA批准ACLX-001的IND申请》


 点击“阅读原文”,立即报名!
点击“阅读原文”,立即报名!



 个人中心
个人中心
 我是园区
我是园区




