 随着人们
健康意识的不断增强,HPV疫苗成为越来越多女性关注的重点。在女性恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌。
3月31日,国药集团中国生物研究院和成都生物制品研究所联合
研发的一类新药“
11价重组人乳头瘤
病毒(HPV)
疫苗”Ⅲ期临床试验召开线上
启动会
。目前国内尚无11价HPV疫苗获批上市,此次中国生物11价HPV疫苗Ⅲ期临床试验的启动,将在不久的将来为广大女性带来福音。
来自申办方中国生物研究院、成都生物制品研究所,研究方广西壮族
自治区疾控中
心、山西省疾控中心、湖南省疾控中心、四川省疾控中心的研究负责人,以及CRO公司负责人等参加启动会。
随着人们
健康意识的不断增强,HPV疫苗成为越来越多女性关注的重点。在女性恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌。
3月31日,国药集团中国生物研究院和成都生物制品研究所联合
研发的一类新药“
11价重组人乳头瘤
病毒(HPV)
疫苗”Ⅲ期临床试验召开线上
启动会
。目前国内尚无11价HPV疫苗获批上市,此次中国生物11价HPV疫苗Ⅲ期临床试验的启动,将在不久的将来为广大女性带来福音。
来自申办方中国生物研究院、成都生物制品研究所,研究方广西壮族
自治区疾控中
心、山西省疾控中心、湖南省疾控中心、四川省疾控中心的研究负责人,以及CRO公司负责人等参加启动会。

中国生物研究院院长李启明与成都生物制品研究所副总经理屈戈分别代表申办方致辞。中国生物11价HPV疫苗作为首个突破目前已上市的9价HPV疫苗、进入Ⅲ期临床的国产化疫苗,意义重大。
希
望在研
究者、申办方、
CRO以及检验中心多方协调努力的基础上,又快又好地完成Ⅲ期临床研究,为HPV疫苗国产化、为中国广大群众的健康福祉作出贡献。
作为总研究负责人,广西疾控中心疫苗临床研究所所长莫兆军宣讲了下阶段研究方的重点工作内容,强调了招募、质控、病例监测、访视率等影响III期临床结果的重点环节,并表示将严格执行临床试验方案和各环节SOP,高质量、高效率开展临床试验工作。
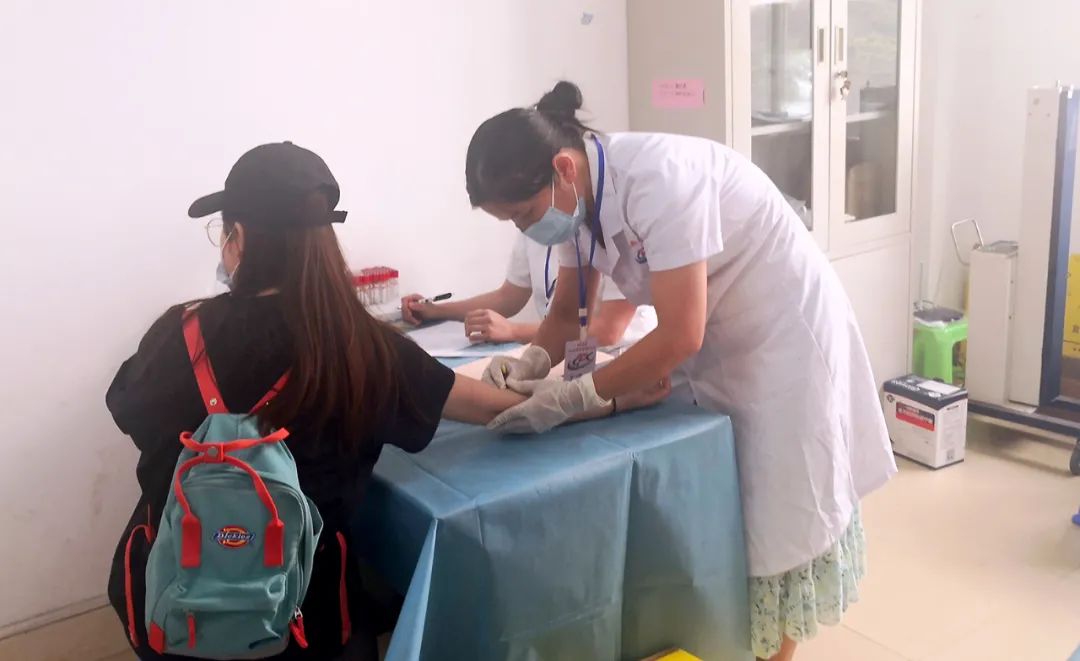
▲2021年6月20日,中国生物11价HPV疫苗Ⅱ期临床试验受试者入组与接种工作正式开始。
中国生物11价HPV疫苗自2019年9月启动I期临床研究,目前已完成I、II期临床试验。2021年12月,国家药品审评中心(CDE)回复意见,同意开展Ⅲ期临床研究。随后,中国生物研究院和成都生物制品研究所联合各方研究者,紧锣密鼓地开展了一系列准备工作,包括研究方案调整、临床用疫苗编盲分装、妇科采样培训及预采样、伦理备案与遗传办报送工作。各参与单位将遵照GCP相关要求,落实好临床研究全过程质控管理,推动疫苗早日上市。
HPV即人乳头瘤病毒。在女性恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌,而大多数宫颈癌均由HPV感染所致。
目前,已经上市的HPV疫苗包括2价、4价和9价,此次启动Ⅲ期临床试验的11价重组HPV疫苗针对中国HPV病毒流行特征,增加了相应的高危HPV型别,进一步扩大了对宫颈癌等疾病的预防范围。
世界卫生组织高度重视HPV疫苗的推广,HPV疫苗在全球范围内的应用取得了很好的效果。但由于HPV涉及到病毒型别较多且整体供应量仍有不足,研发更适合国人接种的HPV疫苗具有重要意义。
中国生物11价HPV疫苗是由中国生物研究院和成都生物制品研究所合作,基于国内流调数据研发的多价HPV疫苗,也是全球第一个9价以上获批临床的HPV疫苗。
 识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
请注明:姓名+研究方向!


本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。

 随着人们
健康意识的不断增强,HPV疫苗成为越来越多女性关注的重点。在女性恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌。
随着人们
健康意识的不断增强,HPV疫苗成为越来越多女性关注的重点。在女性恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌。


 识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!





 个人中心
个人中心
 我是园区
我是园区




