如果您喜欢CROU制药在线推送的这篇文章
欢迎点赞和转发哦~
【线上】2022制药企业工程项目实施全生命周期及设备维保管理案例分析专题培训班
【线上】2022基于化学创新药案例的药物分析人员关键岗位技能提升专题培训班
【线上】2022 OTC药物研发立项策略分析及实施要求解析高级研修班
【杭州 北京】2022生物药申报资料CTD准备全流程实操演练专题培训班
【线上】2022统计学工具在研发注册、分析方法开发、项目管理及分析评价中的应用专题培训班
【线上】2022药品注册(研制和生产)现场核查与GMP检查二合一实战培训班
【线上】2022跨越基层-cGMP框架下制药企业储备生产负责人能力提升研修班
↑点击以上链接即可跳转培训内容界面
对于制药行业来讲,制药用水系统工作之所以如此的重要,不仅仅是制药行业法规与产品质量的要求,更是科学和技术发展的必然,是人们对药品质量改进和风险控制规律认识的结果。——《制药用水系统》
本期主要介绍制药用蒸汽系统的验证内容,仍然是从大家熟知的4Q展开的,内容如下:
1. 蒸汽的分类——工业蒸汽、工艺蒸汽和纯蒸汽。三者的区别在于是否离产品越来越近,罐子夹层的加热通常用工业蒸汽、最终产品的灭菌通常使用工艺蒸汽、无菌生产用设备器具及管道的灭菌通常使用纯蒸汽。
2. 4Q——主要针对的是纯蒸汽系统,4Q的内容大体与注射用水的类似,在最后的PQ阶段,可有两种方案,原文以表格的形式给大家做了介绍,如有需要,可参考最后的内容。
13. 3 制药用蒸汽系统验证
蒸汽在制药企业中是一种重要的公共工程,主要为制药用水的制备、工艺设备的温度控制提供热源,用于无菌工艺设备、器具、最终灭菌产品的灭菌等。蒸汽可大致分为工业蒸汽 (Plant steam)、工艺蒸汽 (Process steam) 和纯蒸汽 (Pure steam)。
(1) 工业蒸汽——用于非直接接触产品的加热,,为非直接影响系统,又可细分为普通工业蒸汽和无化学添加蒸汽。
① 普通工业蒸汽。由市政用水软化后制备的蒸汽,属于非直接影响系统,用于非直接接触产品工艺的加热,一般只要考虑系统如何防止腐蚀。
② 无化学添加蒸汽。由纯化过的市政用水添加絮凝剂后制备的蒸汽,非直接影响系统。主要用于空气加湿,属于非直接接触产品的加热,用于非直接接触产品工艺设备的灭菌,废料废液的灭活等。蒸汽中不应该含有氨、肼等挥发性化合物。
(2) 工艺蒸汽——一般为直接影响系统,主要用于最终灭菌产品的加热和灭菌,冷凝液最少应该满足城市饮用水的标准。
(3) 纯蒸汽——直接影响系统,由纯化水或者注射用水经蒸馏方法制备而成,冷凝液需满足注射用水的要求。主要用于无菌生产设备器具、管道等的灭菌。欧盟和FDA要求灭菌用纯蒸汽必须进行不凝性气体、干度、过热度的确认。
13.3.1 设计确认
在施工之前,纯蒸汽系统的设计文件 (URS、FDS、DDS等) 都要逐一进行检查已确保能够完全满足URS及GMP中的所有要求。设计确认应该持续整个设计阶段,从概念设计到开始采购施工,应该是一个动态的过程。纯蒸汽系统的设计确认中最少应该包含以下内容。
① 设计文件的审核。制备和分配系统所有设计文件 (URS、FDS、P&ID、计算书、设备清单、仪表清单等) 内容是否完整、可用且是经过批准的。
② 纯蒸汽的质量标准。制备和分配的蒸汽质量是否满足工艺的要求。
③ 纯蒸汽发生器的原水质量及供应能力。纯蒸汽的供水通常使用纯化水或者注射用水,如果采用饮用水必须经过适当的预处理。纯蒸汽的制备工艺必须考虑去除内毒素、不凝性气体等。
④ 纯蒸汽使用点的用途、压力、流速等要求。通常是通过表格将所有的用点信息进行汇总,包括用途、使用压力、流速要求、使用时间等,评估系统设计是否满足各用点以及峰值使用量。
⑤ 系统材质的要求。纯蒸汽系统通常采用316或者316L级别的不锈钢,至少采用机械抛光,管道需要卫生型连接。
⑥ 管道及疏水装置安装。纯蒸汽管道应尽量采用焊接和卫生型连接形式,卫生型球阀在蒸汽系 统中是可接受的。水平管网需要有坡度,主管网和各用点需安装疏水装置及时排除冷凝水。
⑦ 纯蒸汽系统的在线监测及日常取样。通常对纯蒸汽发生器的出口通过在线冷凝器的监测冷凝液的电导率、出口温度和压力,分配系统需根据实际使用要求及潜在的风险来决定是否需要在线监测,但是系统设计必须保证能够离线取样。
13.3.2 安装确认
纯蒸汽系统的安装确认通常可以遵循纯化水、注射用水系统的确认要求,但是纯蒸汽系统也有其特殊的确认项目。
(1) 安装确认需要的文件
① 由质量部门批准的安装确认方案。
② 竣工文件包。工艺流程图、管道仪表图、部件清单及参数手册、电路图、材质证书、焊接资料、焊点图、内窥镜检查记录、压力测试及清洗钝化记录、设备出厂合格证等。
③ 关键仪表的技术参数及校准记录。
④ 安装确认中用到的仪表的校准报告。
⑤ 系统操作维护手册。
⑥ 系统调试记录如FAT、SAT记录。
(2) 安装确认包括的项目
① 竣工版的工艺流程图、管道仪表图的确认。应该检查这些图纸上的部件是否正确安装,检查标识、位置,安装方向、取样阀位置、在线仪表位置、排水空气隔断位置等。这些图纸对于创建和维 持水质以及日后的系统改造是很重要的。另外系统轴测图有助于判断系统是否能保证排空性,如有必要也需进行检查。
② 系统关键部件的确认。检查系统中所有关键部件安装是否正确,型号、技术参数是否与设计文件保持一致,如系统中SIP用点温度探头安装位置是否合适、 疏水器前后管网长度是否合适等。
③ 仪器仪表校准。系统关键仪表和安装确认用的仪表是否经过校准并在有效期内,非关键仪表校准如果没有在调试记录中检查,那么就在安装确认中进行检查。
④ 系统材质和表面粗糙度。检查系统的关键部件的材质和表面粗糙度是否符合设计要求,阀门和管道连接的垫片是否能够耐受高温。
⑤ 焊接记录文件的确认。包括标准操作规程、焊接资质证书、焊接检查方案和报告、焊点图、焊接记录等,其中焊接检查最好由系统使用者或者第三方进行,如果施工方进行检查应该有系统使用 者的监督和签字确认。
⑥ 管路压力测试、清洗钝化的确认。压力测试、清洗钝化是需要在调试过程中进行的,安装确认需对其是否按照操作规程成功完成进行检查并且有文件记录。
⑦ 系统坡度和死角的确认。系统管网的坡度应该保证能在最低点排空,无死角对于纯蒸汽系统来说是良好工程规范的要求,如用户有特殊要求也应进行检查。
⑧ 公用工程的确认。检查公用系统包括电力连接、压缩空气、工业蒸汽、供水系统等已经正确连接并且其参数符合设计要求。
⑨ 自控系统的确认。自控系统的安装确认一般包括硬件部件的检查、电路图的检查、输入输出 的检查、HMI操作画面、软件备份的检查等。
13.3.3 运行确认
(1) 运行确认需要的文件
① 由质量部门批准的运行确认方案。
② 供应商提供的功能设计说明、系统操作维护手册。
③ 系统操作维护标准规程。
④ 系统安装确认记录及偏差报告。
(2) 运行确认的测试项目
① 系统标准操作规程的确认。系统标准操作规程 (操作与维护等SOP) 在运行确认时应具备草稿,在运行确认过程中审核其准确性、适用性,可以在PQ第一阶段结束后对其进行审批。
② 检测仪器的校准。在OQ测试中需要对水质进行检测,需要对这些仪器是否在校准期内进行检查。
③ 纯蒸汽发生器自控系统的确认。
a .系统访问权限。检查不同等级用户密码的可靠性和相应等级的操作权限是否符合设计要求。
b .紧急停机测试。检查系统在各种运行状态中紧急停机是否有效,系统停机后系统是否处于安全状态,存储的数据是否丢失。
c .报警测试。系统的关键报警是否能够正确触发,其产生的行动和结果是否和设计文件一致。尤其注意公用系统失效的报警和行动。
d .数据记录。数据的存储和备份是否和设计文件一致,打印功能是否正常。
④ 系统运行参数。将制备系统开启进入正常生产状态,检查在线生产参数是否稳定,是否存在泄漏,是否满足URS要求。
⑤ 分配系统确认。在正常生产状态下,各用点压力是否满足工艺要求,在峰值用量下供给压力是否稳定,疏水器的疏水功能是否正常。
⑥ 蒸汽质量确认。检查纯蒸汽发生器及分配系统用点的蒸汽质量 (不凝性气体、干度、过热度) 是否满足URS要求,可以在线测试或者通过特殊的取样管进行测试。取样应该尽量靠近用点,如果没有合适的理由不建议只在系统的某一个位置进行测试。
13.3.4 性能确认
一般来说,制药用蒸汽系统的性能确认和纯化水、注射用水系统的三阶段法取样周期是一样的,但是仍有其特殊性。
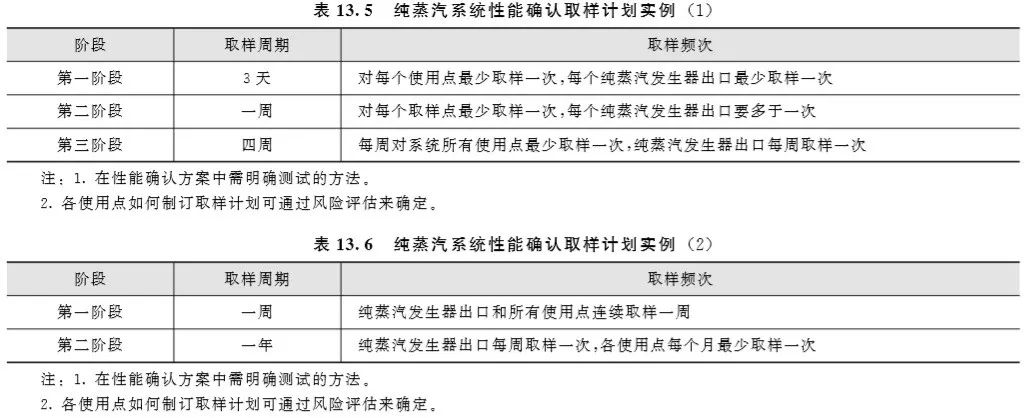
(1) 纯蒸汽系统的性能确认 纯蒸汽系统的性能确认通常需要在纯蒸汽发生器的出口和各个使用点进行取样,非关键的用点可以根据风险评估并有适当的理由时在该用点的下游用点进行取样。通常通过移动冷凝器把纯蒸汽冷却成注射用水来确认纯蒸汽的质量,可接受标准为药典对注射用水的质量要求。纯蒸汽的性能确认最好按照注射用水的 “三阶段法” 进行,但由于纯蒸汽系统的特殊性,也可以采用其他的确认周期,表13.5和表13.6是两个纯蒸汽系统性能确认取样计 划的实例。
(2) 工艺蒸汽系统的性能确认 一般来说,工艺蒸汽的冷凝液需满足饮用水的标准,采用TOC、电导率检测可以判断系统是否受到污染,这些标准可以在PQ期间建立,并在日常监测中进行评估。PQ周期同样可按照3个阶段进行。
① 第一阶段。一般来说只是收集系统质量的信息阶段。系统是否被污染的标准可以在第二阶段进行评估制订。如果用户已经确定了质量标准,可直接进入第二阶段。
② 第二阶段。这个PQ阶段取样次数不能少于3次。每次取样的时间间隔不能少于24h,但是不能超过7d。
③ 第三阶段。为日常监测阶段,应该最少每月取样一次。
来源:张工臣老师
近期培训

长按二维码关注我们



 个人中心
个人中心
 我是园区
我是园区